Uran (prvek)
Uran (chemická značka U, latinsky Uranium) je radioaktivní chemický prvek šedobílé barvy, která díky oxidaci po čase přechází k šedé barvě. Patří mezi kovy, přesněji do skupiny aktinoidů. Prvek objevil v roce 1789 Martin Heinrich Klaproth a v čisté formě byl uran izolován roku 1841 Eugène-Melchior Péligotem.[3]
| Uran | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Vysoce obohacený uran | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Uran, U, 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Uranium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 7. perioda, blok f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Aktinoidy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 4,0 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 3,3×10−3 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | stříbrobílý, vlivem oxidace našedlý kov | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 238,029 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 138,5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 153 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | (U3+) 104 pm (U4+) 89 pm (U5+) 84 pm (U6+) 80 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Rn] 5f3 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | III, IV, V, VI | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,38 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 6,08 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 12,01 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 20,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Čtvrtá | 36,9 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | α-modifikace kosočtverečná bazálně centrovaná a = 285,360 pm b = 586,984 pm c = 495,552 pm β-modifikace čtverečná a = 1 075,9 pm c = 565,6 pm γ-modifikace krychlová tělesně centrovaná a = 352,5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 12,49×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota změny modifikace | 667 °C (α → β) 772 °C (β → γ) °C (940,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 19,01 g/cm3 (mod. α, 25 °C) 18,108 g/cm3 (mod. β) 18,06 g/cm3 (mod. γ) 17,27 g/cm3 (kapalina při tt) 17,00 g/cm3 (1 300 °C) 16,68 g/cm3 (1 500 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdost | 6,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Povrchové napětí | 1 500 mN/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | (20 °C) 3 155 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | (0 °C) 27,0 W m−1 K−1 (25 °C) 27,5 W m−1 K−1 (100 °C) 29,1 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární atomizační entalpie | 527 ± 13 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní molární entropie S° | 50,20 J K−1 mol−1 199,66 J K−1 mol−1 (plyn) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 1 132,3 ± 0,8 °C (1 405,45 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 3 818 °C (4 091,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo tání | 82,67 J/g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo varu | 1 877 J/g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpie změny modifikace ΔHα→β | 11,7 kJ/mol (α → β) 20,5 kJ/mol (β → γ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 0,116 2 J K−1 g−1 0,099 5 J K−1 g−1 (plyn) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | (20 °C) 3,24×106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 32×10−8 Ω m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplotní součinitel elektrického odporu | 0,002 1 K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | (U3+ → U0) -1,789 V (U4+ → U3+) -0,607 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná magnetická susceptibilita | 1,72 cm3/g | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Nebezpečí[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktivní | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-věty | R26/28, R33, R53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-věty | (S1/2), S20/21, S45, S61 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Prvek byl pojmenován podle tehdy nově objevené planety Uran, která dostala jméno podle boha Urana v řecké mytologii (otec Titánů a první bůh nebes, manžel bytosti Gaia). Uran se tak stal prvním prvkem pojmenovaným podle nově objevené planety – později následovaly ještě neptunium a plutonium.
Základní fyzikálně-chemické vlastnosti
Vzhled, základní vlastnosti
Uran je v čistém stavu stříbrobílý lesklý kov, který na vzduchu pozvolna nabíhá – pokrývá se vrstvou oxidů. Rozmělněný na prášek je samozápalný. Není příliš tvrdý a lze jej za obyčejné teploty kovat nebo válcovat. Při zahřívání se stává nejprve křehkým, při dalším zvyšování teploty je však plastický. Při teplotách pod 0,68 K se stává supravodičem I. typu.
Hustota
Hustota (specifická hmotnost) uranu při 25 °C je 19,01 g·cm−3, uran tak patří k nejtěžším prvkům vůbec, je zhruba o 70 % těžší než olovo.
Z dalších prvků je těžší pouze osmium (22,57 g·cm−3), iridium (22,50 g·cm−3), platina (21,45 g·cm−3) či rhenium (20,50 g·cm−3); jen o málo větší hustotu má wolfram (19,25 g·cm−3) a zlato (19,30 g·cm−3). Vysoká hustota uranu je důvodem pro mnohá jeho nejaderná využití.
Elektronová konfigurace (podrobný rozpis)
Elektronová konfigurace atomu: K: 2, L: 8, M: 18, N: 32, O: 5s2, 5p6, 5d10, 5f3 P: 6s2, 6p6, 6d1 Q: 7s2; celková konfigurace: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 5f3 6d1 7s2.
Historie
Historie do objevu radioaktivity
Uran se už v roce 79 př. n. l. používal k barvení glazur (nálezy poblíž Neapole s 1% výskytem oxidu uranu).
První laboratorně izolovanou sloučeninou uranu byla uranová žluť 1789 izolovaná lékárníkem a profesorem chemie Martinem Heinrichem Klaprothem, jenž objevil nebo spoluobjevil i několik dalších prvků – (zirkonium, titan, cer a tellur). Klaproth analyzoval rudu z dolu George Wagsfort ve Wittingshalu u Johanngeorgstadtu v Sasku. Působením kyseliny a po silném zahřátí získal žlutý prášek, uran, jak se domníval. Objev oznámil v projevu před Pruskou akademií věd 24. září 1789 a pojmenoval prvek podle planety Uran objevené krátce předtím (1781), původní název ovšem byl uranit, až v roce 1790 byl přejmenován na uranium. Ve skutečnosti však šlo o jeho síran, čistý uran se podařilo získat až v roce 1841 Francouzi Eugene-Melchior Peligotovi.
Uran se pak používal k barvení skla a glazur, kterým dodával zelenou nebo žlutou barvu (v Jáchymově od roku 1826), těžil se v českém Jáchymově a v britském Cornwallu. Toto použití podstatně kleslo v 2. polovině 20. století. Podle Ottova slovníku naučného bylo v roce 1904 vytěženo 17 193 kg uranu.
Historie po objevu radioaktivity
V roce 1896 zjistil Henri Becquerel, že uran je radioaktivní a – pokud nepočítáme objev rentgenových paprsků krátce předtím – vlastně tím radioaktivitu objevil. Marie Curie-Skłodowská se svým manželem Pierrem Curie poté z uranové rudy (jáchymovského smolince) izolovala 2 nové prvky: nejdřív polonium a o něco později pak i radium. Uranové rudy pak byly až do 30. let (objev umělých izotopů) používány pro výrobu radia v něm obsaženého (radia se velmi brzo po objevu začalo v malých množstvích používat pro lékařské účely). Podle Františka Běhounka bylo ovšem za celou tuto dobu izolováno jen kolem 1,5 kg radia.
Pro účely jaderného průmyslu se začal uran využívat až během (resp. po) druhé světové války.
První umělá jaderná řetězová reakce (tzv. Fermiho reakce) byla spuštěna 2. prosince 1942 italským fyzikem E. Fermim na hřišti Chicagské univerzity (CP-1). Prostřednictvím jaderného reaktoru (EBR-1) byl poprvé vyroben proud 20. prosince 1951, první jaderná elektrárna byla zprovozněna v roce 1954 v Obninsku v SSSR.
Izotopy
V přírodě se uran nachází v nejrůznějších rudách, ovšem jen v nízkých koncentracích 0,04 – 3 %. Vyskytuje se zde jako směs izotopů 238U (99,274 2 %) a 235U (0,720 4 %) a jen ve velmi malé míře 234U (0,005 4 %).
Uměle bylo syntetizováno mnoho dalších izotopů, včetně přirozeně se vyskytujících tak byla dosud (2018) objevena celá souvislá řada s nukleonovými čísly 216 až 243:[4]
| Izotop | Poločas přeměny | Druh rozpadu | Produkt rozpadu |
|---|---|---|---|
| 216U | 4,5 ms | α | 212Th |
| 217U | 16 ms | α | 213Th |
| 218U | 510 ms | α | 214Th |
| 219U | 42 μs | α | 215Th |
| 220U | ? | ε / α | 220Pa/ 216Th |
| 221U | 660 ns | α | 217Th |
| 222U | 4,7 μs | α | 218Th |
| 223U | 18 μs | α (99,8 %)/ ε (0,2 %) | 219Th/ 223Pa |
| 224U | 840 μs | α | 220Th |
| 225U | 95 ms | α | 221Th |
| 226U | 268 ms | α | 222Th |
| 227U | 1,1 min | α | 223Th |
| 228U | 9,1 min | α (>95 %) / ε (<5 %) | 224Th / 228Pa |
| 229U | 58 min | ε (80 %)/ α (20 %) | 229Pa / 225Th |
| 230U | 20,8 d | α (100 %) / SF (<10−10) % / 24Ne (5×10−12 %) | 226Th / různé / 206Pb |
| 231U | 4,2 d | ε (100,00 %)/ α (≈4,0×10−3 %) | 231Pa/ 227Th |
| 232U | 68,9 r | α (100 %) / 24Ne (9×10−10 %) SF (3×10−12 %) | 228Th / 208Pb / různé |
| 233U | 159 200 r | α (100 %) / 24Ne (9×10−10 %) SF (<6×10−11 %) / 28Mg (<10−13 %) | 229Th / 209Pb různé / 205Hg |
| 234U | 245 500 r | α (100 %) / SF (1,6×10−9 %) | 230Th / různé |
| 235U | 7,04×108 r | α (100 %) / SF (7×10−9 %) 28Mg (8×10−10 %) / 20Ne (8×10−10 %) 25Ne (8×10−10 %) | 231Th / různé 207Hg / 215Pb 210Pb |
| 236U | 2,342×107 r | α (100 %) / SF (9,4×10−8 %) | 232Th |
| 237U | 6,75 d | β− | 237Np |
| 238U | 4,468×109 r | α (100 %) / SF (5,4×10−5 %) | 234Th / různé |
| 239U | 23,45 min | β− | 239Np |
| 240U | 14,1 h | β− | 240Np |
| 241U | ? | β− | 241Np |
| 242U | 16,8 min | β− | 242Np |
| 243U | ? | ? | ? |
Výskyt
Minerály a rudy
Nejstarší, nejznámější a patrně nejdůležitější rudou je uraninit (jeho ledvinitá forma se nazývá smolinec) neboli nasturan. Chemicky jde o UO2 s příměsemi oxidů olova, thoria a radia. Druhou nejdůležitější rudou je mikroskopický koffinit U(SiO4)1-x(OH)2, který často doprovází uraninit. Další rudy uranu (a zároveň i rudy vanadu) jsou carnotit K2(UO2)2(VO4)2·3H2O a ťujamunit Ca(UO2)2(VO4)2·xH2O. Dále např. ulrichity, což jsou minerály s různým poměrem oxidu uraničitého a oxidu uraničito-uranového, chemicky UO2.U3O8. Méně významné minerály uranu jsou bröggerit, cleveit, nivenit (Norsko) či zippeit (skupina minerálů), autunit a johannit.
Výskyt ve světě
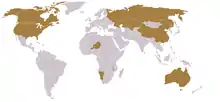
Uranové rudy se ve velkém množství vyskytují v Kanadě, Austrálii, USA, Nigeru, Nigérii, Kongu, Zairu, Namibii, Gabonu, Rusku, Uzbekistánu, Kazachstánu a Jihoafrické republice. Nové významné ložisko bylo v roce 2007 objeveno v Guineji.[5]
V Evropě se uran těží nebo těžil v Sasku, v anglickém Cornwallu, v Rumunsku, na Ukrajině a v Česku (viz dál Výskyt, těžba a zpracování v Česku). Přestože také Slovensko má podle průzkumů významnější zásoby uranu, těžba se neplánuje. Obecně však těžba v Evropě není z celosvětového hlediska příliš významná.
Podle výroční zprávy OECD z roku 2018[6] ve světe existují zásoby na více než 130 let, nedostatek uranu se nepředpokládá ani v případě masivního rozvoje jaderné energetiky.
Velikost těžitelných zásob uranu přesahuje 20 Mt, společně s uranem z moří, z hornin a z thoria dosahují těžitelné zásoby dokonce nejméně 160 Mt.
Značné rezervy navíc existují v recyklaci vyhořelého paliva (zásoby by se pomocí recyklace, která se dosud nevyplatí, zvýšily o 1/3) a ve využití rychlých množivých reaktorů. V případě využití rychlých množivých reaktorů by zásoby vystačily na tisíce let[7].
Velkou výhodou při těžbě uranu je, že v řadě nalezišť je možné těžit jej současně s jinými surovinami (např. australský megadůl Olympic Dam).
Výskyt v mořské vodě
Uran se vyskytuje rovněž v mořské vodě a to v relativně velké koncentraci kolem 3,3 mikrogramů na litr. Odhaduje se, že v mořské vodě jsou celkově obsaženy 4 miliardy tun uranu, zatím však jeho získávání z vody není efektivní. V sladkovodních vodách je obsah uranu velmi proměnlivý.
Výskyt v uhlí
Uran je obsažen mimo jiné rovněž v uhlí, což je důvod, proč tepelné elektrárny do prostředí uvolňují celkově mnohem víc radioaktivity než elektrárny jaderné. Z uhlí by dokonce v budoucnu mohla být získávána podstatná část světové spotřeby uranu.[8]
Výskyt, těžba a zpracování v Česku

V minulosti byla významná těžba v Česku, zde zejména v Jáchymově (do 2. poloviny 20. století zdaleka nejvýznamnější zdroj), v Horním Slavkově, v Příbrami a v křídových pískovcích v okolí Stráže pod Ralskem. Po roce 2000 byla v Česku byla uranová ruda těžena už jen poblíž Dolní Rožínky u Žďáru nad Sázavou, šlo do dubna 2017 o jedinou probíhající těžbu v Evropské unii. Těžba zde byla v květnu 2007 prodloužena na dobu neurčitou, po dobu ekonomické výhodnosti.[9][10][11][12] Zásoby na ložisku byly vytěženy k dubnu 2017 a tím došlo k ukončení těžby po 60 letech těžební činnosti.[13]
Australská firma Uran Limited usiluje o získání práv na průzkum uranových ložisek na Jihlavsku[14] Spor o případnou těžbu uranu probíhá také v Podještědí na Liberecku, kde o těžbu v ložisku Osečná-Kotel má zájem společnost Urania Mining, jejímž 100% vlastníkem je australská firma Discovery Minerals Pty Ltd. Firma požádala o průzkumné vrty na ložiscích Osečná-Kotel a Ploužnice, ministerstvo životního prostředí sice žádost v květnu 2008 zamítlo, ale firma Urania Limited se odvolala.[15] Na jaře roku 2010 začalo Ministerstvo průmyslu a obchodu opět uvažovat o těžbě uranu v Libereckém kraji. Hlavním důvodem je snížení závislosti na dovozu paliva ze zahraničí. Odpůrci argumentují především nedostatkem zkušeností se sanací uzavřených dolů a tím, že ložiska leží v chráněné krajinné oblasti Jizerské hory.[16]
Hlubinná těžba uranu se v okolí Stráže pod Ralskem prováděla po léta za pomocí vhánění silných kyselin do podzemí, což vedlo ke značnému zamoření podzemních vod. Po skončení vlastní těžby, která dobíhala během roku 2017, se zamořená podzemní voda odčerpávala, aby se chemická kontaminace nešířila do přiléhající zásobárny pitné vody. Celkové náklady na sanaci zamoření, které v lokalitě způsobila těžba uranu, byla v roce 2015 odhadována na 50 miliard korun.[17]
V bývalém Československu se v minulosti zpracovávala uranová ruda v mydlovarském podniku MAPE. Areál bývalé chemické úpravny je již zlikvidován a je dále zajišťována dlouhodobá sanace odkališť rmutu, která představují jednu z velkých ekologických zátěží v České republice.
Těžba a úprava
Uranová ruda obsahující smolinec se nejprve vylouží kyselinou sírovou, dusičnou nebo chlorovodíkovou. K roztoku se poté přidá přebytek Na2CO3 a Ca(OH)2 k vysrážení hliníku, železa, kobaltu a manganu; vzniklý rozpustný uhličitan uranylo-sodný se rozloží kyselinou chlorovodíkovou a uran se vyloučí ze získaného roztoku soli uranylu zaváděním amoniaku jako (NH4)2U2O7, který se potom žíháním převede na oxid U3O8.
Jde-li o rudy obsahující měď a arsen, vylučuje se uran z uhličitanového roztoku po okyselení kyselinou chlorovodíkovou obvykle nejdřív přidáním NaOH jako Na2U2O7. Tato sloučenina se opět rozpustí v kyselině chlorovodíkové a do roztoku se zavádí H2S, čímž se srazí CuS a As2S3. Z filtrátu zbaveného varem sirovodíku se potom při přidání amoniaku vylučuje uran jako (NH4)2U2O7. Vychází-li se z carnotitu, musí být použito metod, které umožňují dělení vanadu a kyseliny fosforečné od uranu. Také pro zpracování rud na uran se užívá zvláštních postupů, například zahřívání v proudu chloru nebo s jinými chloračními činidly SCl2, SOCl2, COCl2, CCl4, přičemž uran sublimuje jako UCl4.
Jak zjistil už Moissan v roce 1883, může se redukce oxidu U3O8 na kov provádět zahříváním s uhlím v elektrické obloukové peci, avšak kov připravený touto cestou obsahuje karbid. Příprava čistého kovu je ztížena nejen sklonem uranu tvořit karbidy, ale i jeho velkou afinitou ke kyslíku a dusíku.
Redukce UCl4 kovovým vápníkem probíhá podle rovnice:
- UCl4 + 2 Ca → U + 2 CaCl2
Redukce UCl4 kovovým draslíkem:
- UCl4 + 4 K → U + 4 KCl
Běžný způsob přípravy čistého kovového uranu pro použití v atomových reaktorech je založen na redukci fluoridu uraničitého kovovým vápníkem:
- UF4 + 2 Ca → U + 2 CaF2
Obohacený uran
Obohacení uranu znamená zvýšení podílu izotopu 235U v uranu nad přirozený podíl 0,71%, typicky na 3-5%.

Pro výrobu paliva pro jaderné reaktory se obvykle používá uran, obsahující kolem 3–4 % 235U. Některé typy reaktorů (plynem chlazené reaktory a tlakovodní reaktory) mohou využívat přírodní neobohacený uran. Při výrobě jaderné zbraně je minimální nutný obsah 235U přibližně 90 %, obvykle se však pro konstrukci atomové bomby využívá uran s ještě vyšším stupněm obohacení.
Oddělení hlavních izotopů uranu 238U a 235U je poměrně značně obtížné. Z hlediska chemického chování jsou oba izotopy prakticky identické a i jejich odlišnosti ve fyzikálních vlastnostech jsou velmi malé. Nicméně oba izotopy vykazují dostatečně odlišné fyzikální vlastnosti, aby je moderními technologiemi bylo možné oddělit. Mezi základní technologické postupy patří elektromagnetická separace, difuze, centrifugální separace a ionizace laserem.
Využití
Z ekonomického a technologického hlediska je důležité především jaderné využití uranu, ostatní možnosti využití jsou spíš vedlejší.
Jaderné využití uranu

Obohacený uran se používá jako palivo v jaderných reaktorech nebo jako náplň jaderných bomb. Pro využití uranu jako jaderného paliva je nutné zvýšit koncentraci izotopu 235U z 0,72 % většinou na 2 až 4 %. Pro použití v jaderné bombě je koncentraci třeba zvýšit na hodnotu přes 95 %.
Z izotopu 238U se v rychlých množivých reaktorech dá vyrábět plutonium, zejména štěpitelný izotop 239Pu. Tento postup se však zatím příliš nepoužívá kvůli vysokým investičním nákladům a vyšší technologické náročnosti.
Štěpitelný je rovněž izotop 233U, který lze množit z thoria.
Výhody energetického využívání uranu
Velkou výhodou energetického využívání uranu je skutečnost, že cena samotného uranu tvoří jen malý podíl v nákladech na výrobu elektřiny z něho (v Česku v roce 2009 kolem 17 %), cena elektřiny je dána především náklady na výstavbu elektrárny. K výrobě elektřiny je třeba o několik řádů menší množství jaderného paliva než fosilních paliv, je proto relativně snadné a levné i shromažďování zásob uranu a jeho skladování. To je velmi výhodné pro zajištění energetické nezávislosti státu dokonce i v případě, že nemá vlastní zdroje uranu. Na rozdíl od ropy je navíc většina zemí vyvážejících uran politicky stabilní a demokratická.
Nevýhody energetického využívání uranu
Těžba uranu představuje vážný zásah do krajiny, ať už jde o rozsáhlé povrchové doly, hlubinnou těžbu nebo těžbu chemickým loužením (metoda in situ). Ta spočívá v pumpovaní obrovského množství roztoku kyseliny sírové nebo uhličité, případně hydrogenuhličitanu sodného, do podzemí s cílem uran rozpustit a následně jej chemicky extrahovat.
Kromě vlastní devastace těžbou představují problém také vytěžené horniny kontaminované radioaktivním či toxickými rozpadovým produkty. V okolí mnoha uranových dolů došlo ke kontaminaci okolí. V případě špatně provedeného chemického loužení uranu mohou být ohroženy zásoby podzemní vody.
Těžba uranu také ohrožuje zdraví pracovníků, zejména v případě historických špatně větraných hlubinných dolů hrozilo zvýšené riziko rakoviny plic (radon).
Nejaderné využití uranu

Jako odpad po obohacování uranu vzniká tzv. ochuzený uran (ochuzený proto, že byl zbaven podstatné části izotopu 235U využitelného jako palivo pro jaderné reaktory). V angličtině se často označuje zkratkou DU (depleted uranium) nebo řidčeji tuballoy.
Uran je pro svou vysokou hustotu využíván všude tam, kde je žádoucí vysoká hmotnost (vyvážení, nutnost dosáhnout vysoké kinetické energie při malém objemu).
Ve starším, ale ještě používaném Boeingu 747 je používán jako vyrovnávací závaží na zádi. Uvádí se, že bylo vyrobeno kolem 600 exemplářů tohoto modelu obsahujícího ochuzený uran, přičemž jednotlivé exempláře obsahují 400–600 kg ochuzeného uranu (jiný pramen uvádí dokonce 400–1 500 kg). Podobným způsoben je využíván rovněž v amerických letadlech McDonnell Douglas DC-10. Jako zátěž je využíván rovněž v plachetnicích, rotorech gyroskopů, ropných vrtných soupravách, údajně dokonce i ve vozech Formule 1. V některých amerických tancích (např. M1 Abrams) je používán jako součást pancíře. Ochuzený uran může být použit rovněž jako stínění před radioaktivitou.
Sloučeniny hexahydrát diurananu sodného (Na2U2O7.6H2O) a hexahydrát diurananu draselného (K2U2O7.6H2O) se dosud označují jako uranová žluť používající se k barvení skla, glazur a porcelánu (barví na žluto až žlutozeleno, přičemž fluoreskuje). Zřejmě se jím však dá barvit i oranžově až rudě. Míra tohoto použití se však v minulosti výrazně snížila. V Česku jsou podle Státního úřadu pro jadernou bezpečnost (SÚJB) 2 výrobci skla barveného uranem, podle úřadu[18] je v Česku vyráběné sklo zdravotně zcela neškodné i při silně konzervativním přístupu hodnocení zdravotního rizika.
Ve fotografii se sloučeniny (solí) uranu (např. UO2(NO3)2 – dusičnan uranylu) používají k zesilování negativů, do tónovacích lázní, zesilovač světlotisku. Kvůli chemické toxicitě se dusičnan uranylu používá pro experimentální vyvolání patologického stavu ledvin u pokusných zvířat.
Octan uranylu UO2(C2H3O2)2.2H2O, NaUO2(C2H3O2) a diuranan amonný (NH4)2U2O7 má význam v analytické chemii.
Uran s obsahem karbidu je vhodným katalyzátorem pro syntézu amoniaku Haberovým způsobem.
Nejaderné využití ve vojenství

Využívá se vedle wolframu pro výrobu protipancéřových projektilů (tzv. šípové, přesněji podkaliberní střely – průměr střely je menší než průměr hlavně, ze které je vystřelena). Působí zde sice především vysoká kinetická energie střely, účinek však zesiluje i to, že po průniku projektilu za pancíř se tlakem a třením rozžhavené úlomky uranu vznítí, což zvyšuje ničivý účinek uvnitř obrněného prostoru. Střely z ochuzeného uranu též mají výhodnější mezní úhel, pod kterým se po zásahu do svého opancéřovaného cíle neodrazí.
Je třeba důrazně upozornit na to, že toto použití jako takové nemá absolutně žádnou souvislost s jaderným využíváním uranu pro výrobu nukleárních zbraní. Důvodem je zde pouze vysoká hustota uranu, pevnost srovnatelná s jeho konkurenčním materiálem wolframem, snadná vznětlivost a relativně nízká cena. Přes poměrně nízkou radioaktivitu 238U však přesto dochází k slabému radioaktivnímu zamoření, míra jeho neškodnosti nebo škodlivosti není dosud dořešena. V posledních letech padlo na Valném shromáždění OSN několik návrhů na prozkoumání účinků zbraní a munice z ochuzeného uranu,[19] které byly přes odpor několika zemí (USA, Izrael, Francie, Česká republika, …) schváleny.[20]
Větší roli přitom hraje ani ne tak radioaktivita ochuzeného uranu (která je nízká, ovšem pokud se dostane dovnitř těla, její účinky jsou vyšší), jako jeho celková toxicita, protože uran stejně jako většina těžkých kovů je pro živé organizmy jedovatý. Jeho velké rozptýlení v prostředí poskytuje možnost dostat se přímo do těla živých organizmů (potravou, pitím nebo vdechnutím).
Tyto střely byly použity spojenci v první válce v Iráku v roce 1991,[21] v Kosovu v roce 1999, pravděpodobně rovněž v Afghánistánu v roce 2001 a od března 2003 i v Iráku během operace Irácká svoboda, kdy bylo podle irácké ministryně zdravotnictví Nermin Othman bombardováním kontaminováno přes 350 míst. Počet rakovinných onemocnění údajně činí 140 tisíc a každý rok je registrováno 7 až 8 tisíc případů rakoviny.[22] Tato data však nebyla potvrzena nezávislými zdroji, naopak podle Světové zdravotnické organizace (WHO) by pro vyvolání rakoviny plic bylo nutné vdechnout velké množství uranového prachu. U jiných typů rakoviny je riziko ještě mnohem menší.[23]
31. října 2007 první výbor OSN schválil většinou hlasů návrh rezoluce požadující přezkoumání zdravotních rizik zbraní používajících ochuzený uran. Pro bylo 122 zemí, proti 6 (včetně Česka,[20] které proti jednáním o omezení zbraňových systémů s ochuzeným uranem hlasovala i 5. prosince[24]).
Sloučeniny uranu

Uran vytváří sloučeniny s oxidačními čísly U3+ až U6+, z nichž nejstabilnější jsou ty s U6+. Rozpustné soli sloučenin uranu jsou barevné. Pokud jejich barva není ovlivněna barvou aniontu, tak uranité soli U3+ mají hnědočervené zbarvení, uraničité U4+ zelenou. Uraničné U5+ se vyskytují v podobě kationtu UO2+, jsou bezbarvé a navíc nestabilní a rozkládají se (disproporcionují) na směs solí uraničitých a uranových. Soli uranové U6+ se vyskytují v podobě kationtu UO22+, tzv. uranylový kationt, který má v roztocích žlutou barvu a je stabilní. Nejběžnější soli, se kterými se dá v praxi setkat (kromě níže popsaných) jsou právě soli, které obsahují kationt uranylu a patří mezi ně např. dusičnan uranylu UO2(NO3)2.
Mezi nejběžnější sloučeniny uranu patří oxid uraničitý UO2, který se v přírodě nachází v podobě minerálu smolince a je základní surovinou pro výrobu kovového uranu. Další z oxidů, který se také vyskytuje v přírodě jako uranová ruda, je směsný oxid uraničito-uranový U3O8 (lze rozepsat na složky – UO2.2UO3 a možno také pojmenovat jako oxid uraničito-diuranový, ale tento název se nepoužívá). Z oxidu uraničitého ho lze připravit žíháním na vzduchu.
K dalším významným sloučeninám uranu patří některé halogenidy – konkrétně chlorid uraničitý UCl4 a fluorid uraničitý UF4, které se používají k výrobě kovového uranu redukcí draslíkem či vápníkem, a fluorid uranový UF6, který se díky tomu, že fluor se v přírodě vyskytuje pouze jako jeden izotop, využívá k separaci 235UF6 a 238UF6 na základě odlišné hmotnosti těchto dvou izotopických sloučenin (viz výše v sekci o obohaceném uranu a jeho výrobě).
Odkazy
Reference
- Uranium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Isotopic compositions of the elements (anglicky)
- name="epa">http://www.epa.gov/radiation/radionuclides/uranium.html (anglicky)
- Chart of Nuclides Archivováno 10. 10. 2018 na Wayback Machine, National Nuclear Data Center, Brookhaven National Laboratory (anglicky)
- V Guinee byla objevena nová ložiska uranu. Novinky.cz [online]. 2007-08-24 [cit. 2019-09-21]. Dostupné online.
- https://read.oecd-ilibrary.org/nuclear-energy/uranium-2018_uranium-2018-en#page1
- Vyhořelé jaderné palivo není odpad | Technický týdeník. www.technickytydenik.cz. Dostupné online [cit. 2020-12-14]. (česky)
- Archivovaná kopie. techtydenik.cz [online]. [cit. 2008-01-03]. Dostupné v archivu pořízeném dne 2011-07-18.
- http://www.mpo.cz/dokument36127.html
- http://www.mpo.cz/dokument8092.html
- Archivovaná kopie. www.ceskenoviny.cz [online]. [cit. 2008-10-24]. Dostupné v archivu pořízeném dne 2011-05-14.
- Archivovaná kopie. www.ekolist.cz [online]. [cit. 2007-06-21]. Dostupné v archivu pořízeném dne 2008-02-24.
- Uranový důl Rožná za dva roky skončí. O práci může přijít tisíc lidí
- http://jihlavsky.denik.cz/podnikani/20070607uran_pruzkum_vysocina.html
- [Lidé dál bojují proti těžbě uranu v Podještědí, MfDnes, 21. listopadu 2008]
- MPO chce podpořit těžbu
- Kvůli nešetrné těžbě uranu na Českolipsku uvolní vláda 4,5 Archivováno 9. 1. 2015 na Wayback Machine miliardy
- http://www.sujb.cz/?c_id=159 dobrozdání SÚJB
- http://www.un.org/Docs/journal/asp/ws.asp?m=A/C.1/62/L.18/rev.1
- https://web.archive.org/web/20170312194241/http://www.un.org/press/en/2007/gadis3357.doc.htm
- Dokument Oil Factor uvádí, že v konfliktu bylo použito přes 325 tun munice s ochuzeným uranem a (na rozdíl od druhé války v Iráku) byla snaha vyhnout se oblastem s civilním obyvatelstvem
- Iraqis blame U.S. depleted uranium for surge in cancer, RIA Novosti, 23. červenec 2007
- Depleted uranium WHO, Fact sheet N°257, Revised January 2003
- Archivovaná kopie. publica.cz [online]. [cit. 2008-01-22]. Dostupné v archivu pořízeném dne 2008-01-20.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu uran na Wikimedia Commons
Obrázky, zvuky či videa k tématu uran na Wikimedia Commons  Slovníkové heslo uran ve Wikislovníku
Slovníkové heslo uran ve Wikislovníku- (česky) Zásoby uranu – krátký rozbor na priroda.cz
- (česky) URAN – bude se u nás znovu těžit? Sdružení Calla, 2008, ISBN 978-80-903910-5-5 (ke stažení v PDF)
- (německy) Minerály uranu


