Oxidační číslo
Oxidační číslo (oxidační stav, oxidační stupeň nebo také mocenství) udává počet elektronů investovaných atomem do chemické vazby. Je to elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony v každé vazbě, které vycházejí z daného atomu, přidělili atomu s vyšší elektronegativitou.
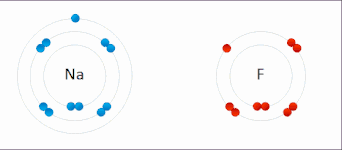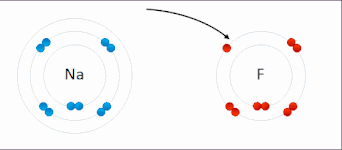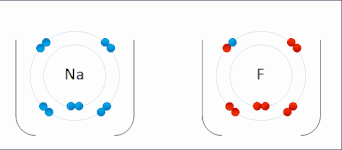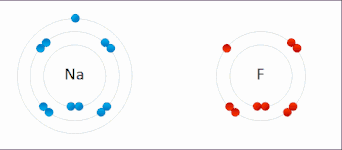
Oxidační číslo atomu neodpovídá jeho reálnému náboji. Tyto dvě veličiny si odpovídají pouze u vysokých oxidačních čísel, kde je ionizační energie mnohem vyšší než energie chemických reakcí. Přiřazování vazebných elektronů jednotlivým atomům pomocí oxidačního čísla je proto formální, ale je to velmi užitečné pro pochopení mnoha chemických reakcí.
Oxidační čísla mohou nabývat kladných hodnot, záporných hodnot, ale mohou mít i hodnotu nula. Pokud atom elektrony přijímá, je jeho oxidační číslo záporné, pokud je odevzdává, je kladné. Molekula v základním stavu má oxidační číslo rovné nule neboli součet oxidačních čísel atomů v molekule je nula. Kladné hodnoty oxidačního čísla se pohybují v rozmezí od I+ do VIII+. Záporné hodnoty se pohybují v rozmezí od I− až do IV−. Atom jednoho prvku může mít různá oxidační čísla podle toho, v jaké sloučenině se zrovna nachází.
U kladných oxidačních čísel se znaménko psát ani číst nemusí, u záporných oxidačních čísel se znaménko bezpodmínečně píše i čte. Oxidační čísla jednotlivých prvků se nacházejí v periodické soustavě prvků.
Definice oxidačního čísla
Termín oxidace byl poprvé použit Antoinem Lavoisierem při zkoumání reakcí látek s kyslíkem. Mnohem později byl význam rozšířen i na další reakce, kterých se kyslík neúčastnil.
IUPAC (Mezinárodní unie pro čistou a užitou chemii)[1] zveřejnila v roce 2016 Komplexní definici stavu oxidace. Zkrácená definice oxidačního stavu (oxidačního čísla) je:
Oxidační stav atomu je nábojem tohoto atomu po iontové aproximaci jeho heteronukleárních vazeb...
Základním principem této definice je, že pomocí aproximace (přiblížení, odhad) považujeme všechny vazby za iontové. Ve spojení mezi dvěma různými prvky jsou tedy elektrony vazby přiřazeny k tomu, který má vyšší elektronegativitu. Ve vazbě mezi dvěma atomy stejného prvku jsou elektrony rozděleny rovnoměrně.
Pro jednoduchý odhad iontové aproximace lze použít Allenovu stupnici elektronegativity. Elektronegativita je schopnost atomů vázat elektrony chemické vazby. Čím je vyšší, tím má atom větší schopnost vázat elektrony. Naopak atom s nízkou elektronegativitou elektrony raději odevzdává.
Nejnižší elektronegativitu má francium s hodnotou 0,7 a nejvyšší elektronegativitu má fluor s hodnotou 3,98. Fluor má proto ve všech svých sloučeninách oxidační číslo I−.
Tabulka elektronegativity
| → Atomový poloměr se zmenšuje → Ionizační energie vzrůstá → Elektronegativita vzrůstá → | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Skupina | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Perioda | |||||||||||||||||||
| 1 | H2.20 | He3.89 | |||||||||||||||||
| 2 | Li0.98 | Be1.57 | B2.04 | C2.55 | N3.04 | O3.44 | F3.98 | Ne3.67 | |||||||||||
| 3 | Na0.93 | Mg1.31 | Al1.61 | Si1.90 | P2.19 | S2.58 | Cl3.16 | Ar3.3 | |||||||||||
| 4 | K0.82 | Ca1.00 | Sc1.36 | Ti1.54 | V1.63 | Cr1.66 | Mn1.55 | Fe1.83 | Co1.88 | Ni1.91 | Cu1.90 | Zn1.65 | Ga1.81 | Ge2.01 | As2.18 | Se2.55 | Br2.96 | Kr3.00 | |
| 5 | Rb0.82 | Sr0.99 | Y1.22 | Zr1.33 | Nb1.6 | Mo2.16 | Tc1.9 | Ru2.2 | Rh2.28 | Pd2.20 | Ag1.93 | Cd1.69 | In1.78 | Sn1.96 | Sb2.05 | Te2.1 | I2.66 | Xe2.6 | |
| 6 | Cs0.79 | Ba0.89 | *
|
Hf1.3 | Ta1.5 | W2.36 | Re1.9 | Os2.2 | Ir2.20 | Pt2.28 | Au2.54 | Hg2.00 | Tl1.62 | Pb2.33 | Bi2.02 | Po2.0 | At2.2 | Rn2.2 | |
| 7 | Fr0.7 | Ra0.9 | **
|
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| Lanthanoidy | *
|
La1.1 | Ce1.12 | Pr1.13 | Nd1.14 | Pm1.13 | Sm1.17 | Eu1.2 | Gd1.2 | Tb1.1 | Dy1.22 | Ho1.23 | Er1.24 | Tm1.25 | Yb1.1 | Lu1.27 | |||
| Aktinoidy | **
|
Ac1.1 | Th1.3 | Pa1.5 | U1.38 | Np1.36 | Pu1.28 | Am1.13 | Cm1.28 | Bk1.3 | Cf1.3 | Es1.3 | Fm1.3 | Md1.3 | No1.3 | Lr1.3 | |||
Výpočty oxidačního čísla
Existují dvě běžně používané metody pro výpočet oxidačního čísla atomu ve sloučenině. První se využívá u sloučenin, které mají Lewisovskou strukturu, jako jsou například organické molekuly. Druhá je použitelná pro jednoduché sloučeniny anorganické i organické.
Výpočet z Lewisovské struktury
Pokud je známa Lewisovská struktura molekuly, lze jednoznačně určit oxidační stav atomů jako rozdíl mezi počtem valenčních elektronů neutrálního atomu a počtem elektronů, které atomu náleží ve vázaném stavu. Pro výpočet oxidačního stavu se předpokládá, že elektrony z vazby mezi dvěma různými prvky patří atomu s vyšší elektronegativitou a elektrony z vazby mezi stejnými atomy se dělí rovným dílem.
Například kyselina octová:
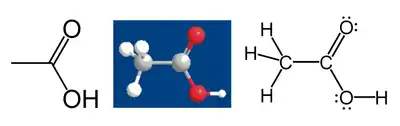
Uhlík z methylové skupiny má šest valenčních elektronů z vazeb k atomům vodíku, protože je více elektronegativní. Další elektron získá z vazby k atomu uhlíku karboxylové skupiny. Celkem mu tedy náleží sedm elektronů. Neutrální atom uhlíku má čtyři elektrony. Rozdíl, 4 − 7 = −3, je oxidační číslo atomu uhlíku.
Výpočet pro jednoduché sloučeniny
Pro jednoduché sloučeniny platí pravidla, která umožňují jednoduše vypočítat oxidační číslo prvku ve sloučenině.
Základní pravidla
- Součet oxidačních čísel všech atomů neutrální nebo nabité sloučeniny musí být stejný jako náboj sloučeniny.
- Součet oxidačních čísel všech atomů neutrální sloučeniny se rovná 0.
- Součet oxidačních čísel všech atomů v iontu se musí rovnat celkovému náboji iontu.
- Prvky v elementárním stavu mají vždy oxidační číslo 0, ať už jsou tvořeny atomy nebo molekulami. Například Li, Mg, B, C, O2,P4, S8, I2, Ar.
- Fluor má vždy oxidační číslo I−, protože je to prvek s nejvyšší elektronegativitou.
- Vodík má běžně oxidační číslo I+. Oxidační číslo I− má pouze ve sloučeninách, kde je vázán k elektropozitivnějšímu prvku (NaH, NaBH4, ...).
- Kyslík má oxidační číslo II−. Výjimku tvoří peroxidy (I−), superoxidy (I/II−), ozonidy (I/III−), difluorid kyslíku OF2 (II+) a difluorid dikyslíku O2F2 (I+).
- Alkalické kovy mají oxidační číslo I+, výjimku tvoří pouze alkalidy.
- Kovy alkalických zemin mají vždy oxidační číslo II+.
- Oxidační číslo iontu atomu odpovídá jeho iontovému náboji. V kationtu Cu2+ má měď oxidační číslo II+, v aniontu Cl− má chlor oxidační číslo I−.
- V případě organických sloučenin s kovalentními vazbami je sloučenina formálně rozdělena na ionty na základě elektronegativity jednotlivých atomů. Pak se předpokládá, že elektrony zapojené do vazby jsou zcela převzaty více elektronegativním atomem
- Většina prvků se může vyskytnout v několika oxidačních číslech.
- Nejvyšší možné oxidační číslo prvku odpovídá číslu hlavní nebo vedlejší skupiny v periodické tabulce, kde se prvek nachází.
- Vedle fluoru mají oxidační číslo I− také ostatní halogeny, chlor, brom a jód. Jsou výjimky: sloučeniny s kyslíkem (oxidy halogenů) nebo interhalogenní sloučeniny.
- Atomy kovů mají v iontových sloučeninách vždy kladné oxidační číslo.
Křížové pravidlo
K tomu, abychom vyjádřili oxidační číslo ve sloučeninách, které mají prvky v různém poměru, nám pomáhá křížové pravidlo. Pomocí tohoto pravidla určíme například oxidační číslo stříbra v Ag2O takto:
- Víme, že kyslík má oxidační číslo II− a jeho dolní index je 1, tedy Ag2? O1II−
- Pokud spojíme dolní index Ag s horním indexem O, platí 2=II
- Pokud spojíme horní index Ag s dolním indexem O, platí ?=1, tedy horní index musí být I
- Vzorec s oxidačními čísly je tedy Ag2I+ O1II−
Křížové pravidlo je možné použít nejenom u kysličníků, ale i u dalších sloučenin jako jsou soli, hydroxidy, kyseliny atd. Pravidlo se pak uplatňuje nejenom mezi jednotlivými prvky, ale mezi celou kationtovou nebo celou aniontovou skupinou. Jestliže tedy máme fosforečnan vápenatý Ca3(PO4)2, křížové pravidlo se používá mezi vápenatým kationtem a fosforečnanovým aniontem.
Přípony podle oxidačního čísla
V názvech anorganických sloučenin je oxidační číslo daného prvku vyjádřeno příponou. Například v chloridu sodném má atom sodíku oxidační číslo I+ (koncovka -ný), v chloridu železitém má atom železa oxidační číslo III+ (koncovka -itý).
| oxidační číslo | přípona přídavného jména | přípona podstatného jména | příklad |
|---|---|---|---|
| I+ | -ný | -nan | chlorid sodný, chlornan sodný |
| II+ | -natý | -natan | sulfid olovnatý, tetrafluoroberyllnatan |
| III+ | -itý | -itan | oxid hlinitý, kyselina boritá, dusitan sodný |
| IV+ | -ičitý | -ičitan | kyselina křemičitá, oxid dusičitý, uhličitan draselný |
| V+ | -ičný, -ečný | -ičnan, -ečnan | kyselina jodičná, oxid vanadičný, oxid fosforečný, dusičnan amonný |
| VI+ | -ový | -an | oxid sírový, síran vápenatý |
| VII+ | -istý | -istan | kyselina chloristá, manganistan draselný |
| VIII+ | -ičelý | -ičelan | oxid osmičelý |
Seznam oxidačních čísel prvků
V tabulce jsou uvedena možná oxidační čísla prvků. Pro oxidační čísla jsou použity běžné číslice, přestože nejčastěji jsou oxidační čísla psána pomocí římských číslic. Tučně jsou zapsány hodnoty hlavního oxidačního čísla prvku. Například pro berylium je to +2.
| Oxidační čísla prvků | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Prvek | Záporná oxidační čísla | Kladná oxidační čísla | skupina | |||||||||||||||
| −5 | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | ||||
| Perioda | ||||||||||||||||||
| 1 | vodík | H | −1 | +1 | 1 | |||||||||||||
| 2 | helium | He | 18 | |||||||||||||||
| 3 | lithium | Li | +1 | 1 | ||||||||||||||
| 4 | berylium | Be | 0 | +1 | +2 | 2 | ||||||||||||
| 5 | bór | B | −5 | −1 | 0 | +1 | +2 | +3 | 13 | |||||||||
| 6 | uhlík | C | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | ||||||
| 7 | dusík | N | −3 | −2 | −1 | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 8 | kyslík | O | −2 | −1 | 0 | +1 | +2 | 16 | ||||||||||
| 9 | fluor | F | −1 | 0 | 17 | |||||||||||||
| 10 | neon | Ne | 18 | |||||||||||||||
| 11 | sodík | Na | −1 | +1 | 1 | |||||||||||||
| 12 | hořčík | Mg | 0 | +1 | +2 | 2 | ||||||||||||
| 13 | hliník | Al | −2 | −1 | +1 | +2 | +3 | 13 | ||||||||||
| 14 | křemík | Si | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | ||||||
| 15 | fosfor | P | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | ||||||
| 16 | síra | S | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | ||||||
| 17 | chlor | Cl | −1 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 17 | |||||||
| 18 | argon | Ar | 0 | 18 | ||||||||||||||
| 19 | draslík | K | −1 | +1 | 1 | |||||||||||||
| 20 | vápník | Ca | 0 | +1 | +2 | 2 | ||||||||||||
| 21 | skandium | Sc | 0 | +1 | +2 | +3 | 3 | |||||||||||
| 22 | titan | Ti | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 4 | ||||||||
| 23 | vanad | V | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | |||||||
| 24 | chrom | Cr | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | |||||
| 25 | mangan | Mn | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | ||||
| 26 | železo | Fe | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 8 | ||||
| 27 | kobalt | Co. | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 9 | |||||||
| 28 | nikl | Ni | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 10 | ||||||||
| 29 | měď | Cu | −2 | 0 | +1 | +2 | +3 | +4 | 11 | |||||||||
| 30 | zinek | Zn | −2 | 0 | +1 | +2 | 12 | |||||||||||
| 31 | gallium | Ga | −5 | −4 | −3 | −2 | −1 | +1 | +2 | +3 | 13 | |||||||
| 32 | germanium | Ge | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | ||||||
| 33 | arsen | As | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | ||||||
| 34 | selen | Se | −2 | −1 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 35 | brom | Br | −1 | +1 | +3 | +4 | +5 | +7 | 17 | |||||||||
| 36 | krypton | Kr | 0 | +1 | +2 | 18 | ||||||||||||
| 37 | rubidium | Ru | −1 | +1 | 1 | |||||||||||||
| 38 | stroncium | Sr | 0 | +1 | +2 | 2 | ||||||||||||
| 39 | yttrium | Y | 0 | +1 | +2 | +3 | 3 | |||||||||||
| 40 | zirkonium | Zr | −2 | 0 | +1 | +2 | +3 | +4 | 4 | |||||||||
| 41 | niob | Nb | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | |||||||
| 42 | molybden | Mo | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | |||||
| 43 | technecium | Tc | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | |||||
| 44 | ruthenium | Ru | −4 | −2 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | ||||
| 45 | rhodium | Rh | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 9 | ||||||
| 46 | palladium | Pd | 0 | +1 | +2 | +3 | +4 | 10 | ||||||||||
| 47 | stříbro | Ag | −2 | −1 | +1 | +2 | +3 | 11 | ||||||||||
| 48 | kadmium | Cd | −2 | +1 | +2 | 12 | ||||||||||||
| 49 | indium | In. | −5 | −2 | −1 | +1 | +2 | +3 | 13 | |||||||||
| 50 | cín | Sn | −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | 14 | ||||||
| 51 | antimon | Sb | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 15 | ||||||
| 52 | tellur | Te | −2 | −1 | +1 | +2 | +3 | +4 | +5 | +6 | 16 | |||||||
| 53 | jód | I | −1 | +1 | +3 | +4 | +5 | +6 | +7 | 17 | ||||||||
| 54 | xenon | Xe | 0 | +1 | +2 | +4 | +6 | +8 | 18 | |||||||||
| 55 | cesium | Cs | −1 | +1 | 1 | |||||||||||||
| 56 | baryum | Ba | 0 | +1 | +2 | 2 | ||||||||||||
| 57 | lanthan | La | 0 | +1 | +2 | +3 | není k dispozici | |||||||||||
| 58 | cer | Ce | +2 | +3 | +4 | není k dispozici | ||||||||||||
| 59 | praseodym | Pr | 0 | +1 | +2 | +3 | +4 | +5 | není k dispozici | |||||||||
| 60 | neodym | Nd | 0 | +2 | +3 | +4 | není k dispozici | |||||||||||
| 61 | promethium | Pm | +2 | +3 | není k dispozici | |||||||||||||
| 62 | samarium | Sm | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 63 | europium | Eu | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 64 | gadolinium | Gd | 0 | +1 | +2 | +3 | není k dispozici | |||||||||||
| 65 | terbium | Tb | 0 | +1 | +2 | +3 | +4 | není k dispozici | ||||||||||
| 66 | dysprosium | Dy | 0 | +2 | +3 | +4 | není k dispozici | |||||||||||
| 67 | holmium | Ho | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 68 | erbium | Er | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 69 | thulium | Tm | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 70 | ytterbium | Yb | 0 | +2 | +3 | není k dispozici | ||||||||||||
| 71 | lutecium | Lu | 0 | +2 | +3 | 3 | ||||||||||||
| 72 | hafnium | Hf | −2 | 0 | +1 | +2 | +3 | +4 | 4 | |||||||||
| 73 | tantal | Ta | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | 5 | |||||||
| 74 | wolfram | W | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 6 | |||||
| 75 | rhenium | Re | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | 7 | |||||
| 76 | osmium | Os | −4 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 8 | |||
| 77 | iridium | Ir | −3 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | 9 | |||
| 78 | platina | Pt | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | 10 | |||||
| 79 | zlato | Au | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +5 | 11 | |||||||
| 80 | rtuť | Hg | −2 | +1 | +2 | 12 | ||||||||||||
| 81 | thallium | Tl | −5 | −2 | −1 | +1 | +2 | +3 | 13 | |||||||||
| 82 | olovo | Pb | −4 | −2 | −1 | +1 | +2 | +3 | +4 | 14 | ||||||||
| 83 | bismut | Bi | −3 | −2 | −1 | +1 | +2 | +3 | +4 | +5 | 15 | |||||||
| 84 | polonium | Po | −2 | +2 | +4 | +5 | +6 | 16 | ||||||||||
| 85 | astat | At | −1 | +1 | +3 | +5 | +7 | 17 | ||||||||||
| 86 | radon | Rn | +2 | +6 | 18 | |||||||||||||
| 87 | francium | Fr | +1 | 1 | ||||||||||||||
| 88 | radium | Ra | +2 | 2 | ||||||||||||||
| 89 | aktinium | Ac | +2 | +3 | není k dispozici | |||||||||||||
| 90 | thorium | Th | +1 | +2 | +3 | +4 | není k dispozici | |||||||||||
| 91 | protaktinium | Pa | +3 | +4 | +5 | není k dispozici | ||||||||||||
| 92 | uran | U | +1 | +2 | +3 | +4 | +5 | +6 | není k dispozici | |||||||||
| 93 | neptunium | Np | +2 | +3 | +4 | +5 | +6 | +7 | není k dispozici | |||||||||
| 94 | plutonium | Pu | +2 | +3 | +4 | +5 | +6 | +7 | +8 | není k dispozici | ||||||||
| 95 | americium | Am | +2 | +3 | +4 | +5 | +6 | +7 | není k dispozici | |||||||||
| 96 | curium | Cm | +3 | +4 | +5 | +6 | není k dispozici | |||||||||||
| 97 | berkelium | Bk | +2 | +3 | +4 | +5 | není k dispozici | |||||||||||
| 98 | kalifornium | Cf | +2 | +3 | +4 | +5 | není k dispozici | |||||||||||
| 99 | einsteinium | Es | +2 | +3 | +4 | není k dispozici | ||||||||||||
| 100 | fermium | Fm | +2 | +3 | není k dispozici | |||||||||||||
| 101 | mendelevium | Md | +2 | +3 | není k dispozici | |||||||||||||
| 102 | nobelium | Ne | +2 | +3 | není k dispozici | |||||||||||||
| 103 | lawrencium | Lr | +3 | 3 | ||||||||||||||
| 104 | rutherfordium | Rf | +4 | 4 | ||||||||||||||
| 105 | dubnium | Db | +5 | 5 | ||||||||||||||
| 106 | seaborgium | Sg | 0 | +6 | 6 | |||||||||||||
| 107 | bohrium | Bh | +7 | 7 | ||||||||||||||
| 108 | hassium | Hs | +8 | 8 | ||||||||||||||
| 109 | meitnerium | Mt. | 9 | |||||||||||||||
| 110 | darmstadtium | Ds | 10 | |||||||||||||||
| 111 | roentgenium | Rg | 11 | |||||||||||||||
| 112 | kopernicium | Kn | +2 | 12 | ||||||||||||||
| 113 | nihonium | Nh | 13 | |||||||||||||||
| 114 | flerovium | Fl. | 14 | |||||||||||||||
| 115 | moscovium | Mc | 15 | |||||||||||||||
| 116 | livermorium | Lv | 16 | |||||||||||||||
| 117 | tennessin | Ts | 17 | |||||||||||||||
| 118 | oganesson | Og | 18 | |||||||||||||||
Reference
V tomto článku byl použit překlad textu z článku Oxidation state na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxidační číslo na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxidační číslo na Wikimedia Commons - (anglicky) Comprehensive definition of oxidation state (IUPAC Recommendations 2016)