Hořčík
Hořčík (chemická značka Mg, latinsky Magnesium) je lehký, středně tvrdý stříbrolesklý kov. Využívá se při výrobě lehkých a pevných slitin, jako redukční činidlo v organické syntéze a při pyrotechnických aplikacích.
| Hořčík | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Hořčík, Mg, 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Magnesium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 2. skupina, 3. perioda, blok s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Kovy alkalických zemin | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 19 000 až 25 000 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 1 350 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Našedlá kovová látka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7439-95-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 24,3050 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 160 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 141±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 173 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Ne] 3s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | +2, +1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 737,7 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 1450 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 7732,7 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Šesterečná | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 14,00×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 1 738 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdost | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak syté páry | 209 Pa při 23K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 1 270 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 156 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 650 °C (923,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 1 091 °C (1 364,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 8,48 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo varu | 128 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 24,869 Jmol−1K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 22,6×106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 43,9 nΩ·m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | −2,372 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | Paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Nebezpečí[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-věty | R11, R15, R17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-věty | S2, S7/8, S43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Základní fyzikálně-chemické vlastnosti
Hořčík je středně tvrdý, lehký, tažný kov, má vyšší hustotu než voda, vede hůře elektrický proud a teplo. Hořčík lze díky jeho dobré tažnosti snadno válcovat na plechy a dráty. Hořčík není tolik reaktivní jako další kovy alkalických zemin, a proto se neuchovává pod petrolejem nebo naftou, ale stačí nádoby se suchým vzduchem. Hořčík se velmi dobře slévá s jinými kovy, ale jen málo z nich má praktické využití, protože se většina snadno oxiduje.
Hořčík reaguje za normální teploty pomalu s kyslíkem a s vodou. Na suchém vzduchu se postupně pokryje vrstvou oxidu, která jej chrání před další oxidací, a lze jej takto uchovávat i poměrně dlouhou dobu. Při hoření hořčíku na vzduchu vzniká velmi intenzivní bílé světlo. S vodou reaguje hořčík za normální teploty velmi pomalu za vzniku hydroxidu hořečnatého. Při vyšší teplotě se hořčík slučuje velmi ochotně téměř se všemi prvky a i s některými sloučeninami – např. při hoření hořčíku v dusíkaté atmosféře vznikne nitrid hořečnatý, který se vodou rozkládá za vzniku oxidu hořečnatého a amoniaku, a při hoření hořčíku v atmosféře oxidu uhličitého vznikne oxid hořečnatý a uhlík.
Hořčík se velmi dobře rozpouští ve všech běžných kyselinách za vzniku hořečnatých solí. Při rozpouštění v koncentrované kyselině sírové uniká oxid siřičitý. Při rozpouštění v kyselině dusičné se podle koncentrace tvoří vedle hořečnatých solí i další látky. Při velmi nízké koncentraci vzniká dusičnan amonný (koncentrace méně než 5 %), při reakci s ředěnou kyselinou dusičnou vzniká oxid dusný (koncentrace 5 %–10 %), s koncentrovanější reaguje za vzniku oxidu dusnatého (koncentrace 10%–asi 50 %) a s koncentrovanou kyselinou reaguje za vzniku oxidu dusičitého (koncentrace 50 %–100 %). S kyselinou chlorovodíkovou a zředěnou kyselinou sírovou reaguje pouze za vzniku hořečnatých solí. S alkalickými hydroxidy hořčík nereaguje.
Historický vývoj
Na konci 17. století se síranu hořečnatého (tzv. hořké soli) používalo v léčitelství. Oxid hořečnatý byl na počátku 18. století nazýván jako hořká zemina. První, kdo začal rozeznávat hořkou a vápennou zeminu, byl Joseph Black roku 1755. Poprvé hořčík v elementární formě elektrolýzou taveniny chloridu hořečnatého MgCl2 připravil sir Humphry Davy roku 1808. Chemickou cestou byl hořčík poprvé připraven působením par kovového draslíku na bezvodý chlorid hořečnatý. Tuto přípravu hořčíku provedl Bussy v roce 1830.
Výskyt v přírodě
Díky své poměrně velké reaktivitě se v přírodě hořčík vyskytuje pouze ve sloučeninách. Ve všech má mocenství Mg2+.
Hořčík je silně zastoupen jak v zemské kůře, tak ve vesmíru, kde vzniká ve hvězdách těžších než Slunce fúzí uhlíku:
2 12
6C → 24
12Mg.
Podle posledních dostupných údajů tvoří hořčík 1,9–2,5 % zemské kůry, čímž se řadí na 6. místo podle výskytu prvků. Jeho procentuální obsah odpovídá 27 640 ppm (2,764 %)(parts per million = počet částic na 1 milion částic) a ve výskytu se řadí za vápník a před sodík a draslík. V mořské vodě se koncentrace hořčíkových iontů udává jako 1,35 g/l a jsou tak po sodíku druhým nejvíce zastoupeným kationtem, mořská voda obsahuje zejména chlorid hořečnatý MgCl2, bromid hořečnatý MgBr2 a síran hořečnatý MgSO4. Ve vesmíru připadá jeden atom hořčíku přibližně na 30 000 atomů vodíku.
Hořčík je také velmi významným biogenním prvkem. Vyskytuje se ve všech zelených rostlinách, kde je součástí chlorofylu. V organismech živočichů se také řadí mezi významné biogenní prvky.
Obsah hořčíku (obvykle uváděný jako chlorid hořečnatý MgCl2) v mořské vodě tvoří významný podíl jeho zastoupení na Zemi.
Z minerálů je velmi hojný dolomit, směsný uhličitan hořečnato-vápenatý CaMg(CO3)2, jehož ložiska se nacházejí v jižní Evropě, Brazílii, jižní Austrálii i Severní Americe. Poněkud vzácněji se vyskytuje čistý uhličitan hořečnatý, MgCO3 – magnezit, který se těží především v rakouských Alpách, na Slovensku, v Koreji a Číně.
K dalším méně významným minerálům patří karnalit KCl·MgCl2·6H2O, bischofit MgCl2·6H2O, periklas MgO, brucit Mg(OH)2, kieserit MgSO4·H2O, epsomit MgSO4·7H2O, kainit KCl·MgSO4·3H2O, polyhalit K2SO4·MgSO4·2CaSO4·2H2O, boromagnesit Mg5B4O11.2½H2O, hydroboracit CaMgB6O11·5H2O, spinel MgO·Al2O3, magnesioferrit MgO·Fe2O3, pleonast (Mg,Fe)O·(Al,Fe)2O3, picotit (Mg,Fe)O·(Al,Cr,Fe)2O3, olivín (Mg,Fe)2[SiO4] a mnoho dalších fosforečnanů, arseničnanů a křemičitanů.
Ročně se vyrobí 100 milionů tun hořčíku a díky jeho vysokému výskytu v nerostech i v mořské vodě lze jeho zásoby považovat za neomezené.
 Dolomit – CaMg(CO3)2
Dolomit – CaMg(CO3)2 Magnezit – MgCO3
Magnezit – MgCO3 Olivín – (Mg, Fe)2[SiO4
Olivín – (Mg, Fe)2[SiO4 Spinel – MgO.Al2O3
Spinel – MgO.Al2O3 Mastek
Mastek Azbest
Azbest
Výroba

Kovový hořčík se průmyslově vyrábí obvykle elektrolýzou roztavené směsi chloridu hořečnatého a chloridu draselného. Chlorid draselný slouží jako přísada ke snížení teploty tání chloridu hořečnatého. Chlorid hořečnatý se získává z mořské vody nebo z koncentrovaných roztoků mořské soli (solanka) nebo tavením karnalitu. Při elektrolýze se na grafitové anodě uvolňuje chlor a na železné katodě hořčík (chlorid draselný se začne rozkládat až po rozložení chloridu hořečnatého). Roztavený hořčík stoupá v tavenině na povrch a sbírá se děrovanými lžícemi.
Další termický způsob, dnes stále ještě hojně využívaný, spočívá v redukci oxidu hořečnatého karbidem vápenatým nebo uhlíkem – karbotermický způsob nebo redukcí oxidu hořečnatého křemíkem – silikotermický způsob.
- Karbotermický způsob se provádí v elektrické obloukové peci při teplotě nad 2000 °C, aby nedocházelo k reakci oxidu uhelnatého s parami hořčíku. Jednodušší je redukce oxidu hořečnatého karbidem vápenatým, která probíhá při teplotě 1200 °C, ale jen za předpokladu nízké ceny karbidu.
- Silikotermický způsob se provádí reakcí páleného dolomitu s křemíkem nebo ferrosiliciem v ocelolitinových retortách zahřívaných na 1200 °C nebo ve vysokovakuových pecích. Destilující hořčík, jehož čistota je 98–99%, kondenzuje v předchlazených nádobách.
Využití



- V běžném životě se nejčastěji setkáme se slitinami hořčíku s hliníkem, mědí a manganem, které jsou známy pod názvem dural. Vyznačují se značnou mechanickou pevností a současně nízkou hustotou. Zároveň jsou značně odolné vůči korozi. Všechny tyto vlastnosti předurčují dural k používání jako optimální materiál v leteckém a automobilovém průmyslu, při výrobě výtahů, jízdních kol, lehkých žebříků ap. Ještě nižší hustotu než dural má slitina s hliníkem s obsahem nejméně 90 % hořčíku, která se nazývá elektron. Další slitina hořčíku je magnalium, které obsahuje 10–30 % hořčíku a 70–90 % hliníku.
- Elementární hořčík je silným redukčním činidlem a jemně rozptýlený kov se využívá k redukcím v organické syntéze a k redukční výrobě jiných kovů (např. uranu) z roztoků jejich solí. V organické syntéze se využívají zejména Grignardova činidla, za jejichž objev získal Victor Grignard Nobelovu cenu.
- Velká reaktivita kovového hořčíku se uplatňuje v metalurgii, kde jeho přídavky odstraňují malá množství síry nebo kyslíku z roztavené oceli. Se směsí s CaO se využívá k odsířování surového železa a deoxidaci neželezných kovů.
- Reakce hořčíku s kyslíkem probíhá za vývoje značného množství tepla (lze tak dosáhnout teplot kolem 2200 °C) a intenzivního světelného záření. Zapálit hořčík ve formě tenké fólie je velmi snadné a může být startérem hoření v různých pyrotechnických aplikacích. Nejznámější příklad pyrotechnické aplikace je bengálský oheň, který se i dnes používá při různých oslavách. Hořčík se při tom používá k zesílení intenzity a zvětšení plamene. Popřípadě lze hořčík v podobě pilin použít k jiskření připomínajícímu jiskření prskavky. V minulosti se směsi práškového hořčíku s okysličovadlem (KClO3, Ba(NO3)2, KClO4) po zapálení používaly namísto dnešních fotografických blesků. Díky tomu, že je v závislosti na množství možné dosáhnout téměř neomezeného světelného výkonu, se tyto tzv. osvětlovací slože používají ještě dnes při fotografování rozsáhlých podzemních prostor.
- Standardní a snadno připravitelné osvětlovací slože:
- 65 % KNO3, 26 % Mg, 9 % dřevěné uhlí
- 66 % KClO4, 34 % Mg
- 50 % KClO4, 50 % Mg (nebo Al)
- Bezpečnostní upozornění: Při hoření hořčíku vzniká i určité množství UV záření. Bez ochranných brýlí není vhodné dívat se přímo do plamene. U směsí velmi jemně práškového hořčíku (pudr) s okysličovadly je hoření tak rychlé, že může přejít ve výbuch. Rizikem je i nízká teplota vzplanutí (250 °C). To má význam v pyrotechnických aplikacích; k osvětlování je nutné použít hořčíkovou krupici či šupinky.
- Standardní a snadno připravitelné osvětlovací slože:
- Oxid hořečnatý má patrně největší praktické průmyslové uplatnění ze všech sloučenin hořčíku. Tato sloučenina má mimořádně vysokou odolnost vůči vysokým teplotám a současně je relativně levně dostupná ve stotunových množstvích. Je proto optimálním materiálem k vnitřnímu vyložení vysokých pecí na výrobu železa a podobné aplikace. Pro tyto účely se ovšem musí speciálně čistit, protože i poměrně malá množství příbuzných prvků (vápník) mohou významně zhoršovat dlouhodobou tepelnou stabilitu magnezitových vysokopecních vyzdívek.
- Hydroxid hořečnatý Mg(OH)2 se využívá proti překyselení žaludku a k výrobě gelů na spáleniny.
- Uhličitan hořečnatý se přidává do průmyslových hnojiv jako složka dodávající rostlinám hořčík potřebný k růstu a zdárnému vývoji. Uplatňuje se také v oblasti sportu – gymnasté, vzpěrači, atleti a horolezci si jemný prášek uhličitanu hořečnatého nanášejí na ruce.
- Síran hořečnatý (MgSO4.7H2O) je také znám pod jménem epsomská sůl (nesprávně Epsomova sůl) a používá se v medicíně jako laxativum (projímadlo), zdroj hořčíku nebo přídavek do léčebných koupelí. Je často obsažen ve vřídelní soli (např. u anglického města Epsomu) a v některých minerálních vodách (např. Zaječická nebo Šaratica). Síran hořečnatý lze v malém množství přidávat ke zlepšení chuťových a biologických vlastností do kuchyňské soli. Podobné medicínské vlastnosti vykazuje i suspenze hydroxidu hořečnatého ve vodě (hořečnaté mléko).
- V laboratoři se při zahřívání nad kahanem používá azbestová síťka – azbest je hořečnatý křemičitan o složení Mg3Si2H4O9 nebo Mg3(Si2O5)(OH)4.
- K výrobě různých užitkových předmětů, např. nástavců plynových hořáků, krejčovské křídy, mastí a líčidel se používá mastek.
- Jeden z hořečnatých minerálů, který je známý jako mořská pěna neboli sepiolit (hydratovaný hořečnatý křemičitan o složení Mg3[Si4O10]. Mg(OH)2. 3 H2O), se používá při výrobě kuřáckých potřeb (zejména dýmek pěnovek či meršánek).
Sloučeniny
Anorganické sloučeniny



- Hydrid hořečnatý MgH2 je bílá pevná látka, která se trochu rozpouští v etheru. S vodou reaguje za vzniku vodíku a hydroxidu hořečnatého. Připravuje se slučováním prvků za přítomnosti jodidu hořečnatého nebo tepelným rozkladem diethylmagnesia.
- Oxid hořečnatý MgO je za normálních podmínek bílý, jemný, drsný prášek s vysokou teplotou tání a varu. Za normální teploty vytváří oxid hořečnatý polymerní molekulu, která je bezbarvá. Avšak v podobě monomeru je oxid hořečnatý červený prášek. Oxid hořečnatý se připravuje spalováním hořčíku v kyslíkové atmosféře nebo tepelným rozkladem hydroxidu hořečnatého.
- Hydroxid hořečnatý Mg(OH)2 je bílý prášek, velmi málo rozpustný ve vodě. Jeho rozpouštěním v kyselinách vznikají hořečnaté soli. Vzniká reakcí hořčíku s vodní parou, rozpouštěním oxidu hořečnatého ve vodě nebo reakcí hořečnatých solí s roztokem alkalického hydroxidu.
Soli
Větší část hořečnatých solí se ve vodě rozpuští, ale část se rozpouští hůře nebo vůbec, všechny soli mají bílou barvu (nebo jsou bezbarvé), pokud není anion soli barevný (manganistany, chromany). Hořečnaté soli vytváří snadno podvojné soli a dnes i komplexy, které ale nejsou pro hořčík a i další kovy alkalických zemin typické.
- Fluorid hořečnatý MgF2 je bílá krystalická látka, která je nerozpustná ve vodě. S jinými fluoridy alkalických kovů vytváří podvojné sloučeniny. Vzniká srážením hořečnatých iontů ionty fluoridovými nebo reakcí hydroxidu hořečnatého či uhličitanu hořečnatého s kyselinou fluorovodíkovou.
- Chlorid hořečnatý MgCl2 je bílá krystalická látka, dobře rozpustná ve vodě. Je to velmi dobré projímadlo. Velmi snadno vytváří s jinými chloridy alkalických kovů podvojné soli. Připravuje se reakcí chlorovodíku s hydroxidem hořečnatým nebo uhličitanem hořečnatým. Může reagovat s vodou za vzniku dichloridoxidu dihořečnatého a kyseliny chlorovodíkové.
- Bromid hořečnatý MgBr2 a jodid hořečnatý MgI2 jsou bílé krystalické látky, velmi dobře rozpustné ve vodě. Jodid hořečnatý se používá v lékařství při léčbě syfilis, skrofulógy a revmatismu. Obě látky se připravují rozpouštěním hydroxidu hořečnatého nebo uhličitanu hořečnatého v příslušných kyselinách.
- Dusičnan hořečnatý Mg(NO3)2 je bílá rozplývavá krystalická látka, velmi dobře rozpustná ve vodě. Připravuje se rozpouštěním hydroxidu hořečnatého nebo uhličitanu hořečnatého v kyselině dusičné.
- Uhličitan hořečnatý MgCO3 je bílý prášek, který je nerozpustný ve vodě. Používá se k přípravě dalších hořečnatých sloučenin. Vyrábí se reakcí hořečnatých kationů s roztokem rozpustného uhličitanu.
- Síran hořečnatý MgSO4 je bílý prášek, který se velmi dobře rozpouští ve vodě. Vyrábí se reakcí uhličitanu hořečnatého, hydroxidu hořečnatého, oxidu hořečnatého nebo hořčíku s kyselinou sírovou.
Organické sloučeniny
Mezi organické sloučeniny hořčíku patří zejména hořečnaté soli organických kyselin a hořečnaté alkoholáty. K dalším hořečnatým sloučeninám patří organické komplexy. Zcela zvláštní skupinu organických hořečnatých sloučenin tvoří organokovové sloučeniny, mezi které patří velmi známé a dnes stále častěji používané Grignardovo činidlo.
Biologický význam hořčíku
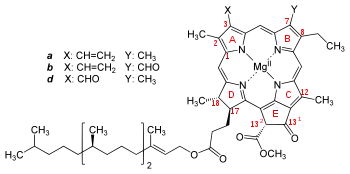
Dostatek hořčíku v potravě je důležitý pro správnou činnost svalů a nervů (mírní podrážděnost a nervozitu), ale i pro uvolňování energie z glukózy a pro správnou stavbu kostí. Udržuje v dobrém stavu oběhový systém a je prevencí infarktu. Řadě žen odstraní potíže spojené s premenstruálním syndromem. Mírní deprese a přispívá ke zdravým zubům.
V kombinaci s vápníkem působí hořčík jako přirozený uklidňující prostředek. Jeho nedostatek často pociťují sportovci, diabetici a lidé, kteří pijí příliš alkoholu. Projevuje se podrážděností, nespavostí, náladovostí, špatným trávením, bušením srdce nebo arytmiemi. Nedostatek hořčíku také může vyvolat deprese, případně záchvat astmatu.
Přirozenými zdroji hořčíku jsou banány, mandle, ořechy, tmavá listová zelenina, obilí, celozrnné pečivo, ale i čokoláda[2]. Uvádí se, že průměrný příjem hořčíku v potravě by měl činit asi 300 mg denně.
Globální význam hořčíku je však dán jeho výskytem v molekule chlorofylu. Tato organická sloučenina má jedinečnou schopnost přeměňovat prostřednictvím fotosyntézy sluneční energii na energii chemické vazby sacharidů vytvářených z oxidu uhličitého a vody. Tím je zdrojem energie pro takřka všechny další biochemické a biologické reakce na Zemi. Zelené zbarvení rostlin je způsobeno právě přítomností chlorofylu, který nejsilněji absorbuje červené a modré světlo.
Poranění způsobená kovovým hořčíkem či slitinami, které jej obsahují, se špatně hojí.[zdroj?]
Doplněk stravy
Vstřebatelnost hořčíku z doplňků stravy ve formě citrátu a oxidu hořčnatého byla podle měření koncentrací v moči vyšší u citrátu; pravděpodobně díky lepší rozpustnosti. Nicméně rozdíl mezi citrátem (7,2 ± 1,48 mmol) a oxidem (6,7 ± 1,43 mmol) byl zanedbatelný. Rozdíl 0,565 mmol, přepočtený na objem těla, je 13,7 mg, a tedy fyziologicky bezvýznamný s ohledem na celkový příjem 800 mg během zkušebního dne.[3][4][5] Porovnání vstřebatelnosti chelátu, oxidu, citrátu zinku a placeba nezjistilo rozdíl mezi oxidem, chelátem a placebem, v případě citrátu pak byla vyšší koncentrace v plazmě (akutní i chronická) o méně než 10%.[6]
Odkazy
Reference
- Magnesium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- http://www.prvky.com/horcik-v-potravinach.html#potraviny – Hořčík v potravinách
- SCHUCHARDT, Jan Philipp; HAHN, Andreas. Intestinal Absorption and Factors Influencing Bioavailability of Magnesium- An Update. Current Nutrition & Food Science. 2017-09-22, roč. 13, čís. 4. Dostupné online [cit. 2019-03-22]. DOI 10.2174/1573401313666170427162740. PMID 29123461. (anglicky)
- LINDBERG, J S; ZOBITZ, M M; POINDEXTER, J R. Magnesium bioavailability from magnesium citrate and magnesium oxide.. Journal of the American College of Nutrition. 1990-02, roč. 9, čís. 1, s. 48–55. Dostupné online [cit. 2019-03-22]. ISSN 0731-5724. DOI 10.1080/07315724.1990.10720349.
- KAPPELER, Dominik; HEIMBECK, Irene; HERPICH, Christiane. Higher bioavailability of magnesium citrate as compared to magnesium oxide shown by evaluation of urinary excretion and serum levels after single-dose administration in a randomized cross-over study. BMC Nutrition. 2017-01-11, roč. 3, čís. 1. Dostupné online [cit. 2019-03-22]. ISSN 2055-0928. DOI 10.1186/s40795-016-0121-3.
- TIGNOL, Professeur. A DOUBLE BLIND, RANDOMISED, MULTICENTRE STUDY COMPARING PAROXETINE 20 MG DAILY VERSUS FLUOXETINE 20 MG DAILY IN THE TREATMENT OF ADULTS WITH MAJOR DEPRESSION.. Clinical Neuropharmacology. 1992, roč. 15, s. 177B. Dostupné online [cit. 2019-03-22]. ISSN 0362-5664. DOI 10.1097/00002826-199202001-00341.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Jursík F.: Anorganická chemie nekovů. 1. vyd. 2002. ISBN 80-7080-504-8
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Carolyn Deanová: Zázrak jménem hořčík, JOTA, 2016, ISBN 978-80-7462-998-3
- http://www.nutritionalmagnesium.org/ Nutritional Magnesium Association - popisuje vliv hořčíku na jednotlivá onemocnění (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu hořčík na Wikimedia Commons
Obrázky, zvuky či videa k tématu hořčík na Wikimedia Commons  Slovníkové heslo hořčík ve Wikislovníku
Slovníkové heslo hořčík ve Wikislovníku- (česky) Chemický vzdělávací portál
- (anglicky) Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Magnesium
