Jod
Jod (též jód; z řeckého ιώδης, iódés, „fialový“), chemická značka I,[pozn. 1] latinsky Iodum, je prvek ze skupiny halogenů, tvoří tmavě fialové destičkovité krystalky. Je to důležitý biogenní prvek, jehož přítomnost v potravě je nezbytná pro správný vývoj organismu.
| Jód | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Jód, I, 53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Iodum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 17. skupina, 5. perioda, blok p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Halogeny | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 0,001 - 0,01 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Šedá látka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7553-56-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 126,90447 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 139±3 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Kr] 4d10 5s2 5p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | VII, V, III, I, -I | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 2,66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 10,084 MJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 18,459 MJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 3,18 MJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Kosočtverečná | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 4933 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 1 270 m/s při 298,15 K m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 0,181 5 W/(m · K) W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 113,7 °C (386,85 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 184,3 °C (457,45 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 1,552 MJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo varu | 4,157 J/moMl | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 54.44 J/mol·K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 1,3×107Ω·m (pro 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | diamagnetické | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Varování[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vlastnosti
Jod je velmi vzácný[zdroj?!] prvek, který se v přírodě vyskytuje pouze ve sloučeninách. Byl objeven roku 1811 francouzským chemikem Bernardem Courtoisem. Pochybný je uváděný přírodní výskyt elementárního jodu z italských sopek jako minerálu.[zdroj?!]
Elementární jod je tmavě fialová až černá látka, která za atmosférického tlaku přechází přímo do plynné fáze, sublimuje. Jeho páry mají fialovou barvu a charakteristický dráždivý zápach. Ve vodě se rozpouští velmi slabě, lépe je rozpustný v ethanolu nebo nepolárních rozpouštědlech jako sirouhlík (CS2), tetrachlormethan (CCl4) nebo benzen (C6H6). Je rozpustný ve vodném roztoku jodidu draselného, s kterým tvoří trijodidový anion, tohoto se využívá v jodometrických titracích.
- KI + I2 → KI3
V literatuře bývá jod někdy označován jako příklad látky neschopné tát, ale pouze sublimovat. Jod se však může vyskytovat v kapalné fázi v rozmezí 113,7–184,3 °C, lze ji demonstrovat v uzavřené zkumavce s jodem ponořené do glycerolu a ohřevem na teplotu přibližně 140 °C.[3]
Výskyt a výroba

Na Zemi je jód přítomen pouze ve formě sloučenin, většina z nich je rozpuštěna v mořské vodě. Je zde přítomen nejen jako jodid, ale také ve formě jodičnanu. Mineralogicky doprovázejí sloučeniny jodu analogické sloučeniny chloru a bromu, ovšem pouze ve velmi nízkých koncentracích.
Relativní zastoupení jodu v zemské kůře i ve vesmíru je velmi nízké. V zemské kůře je jod přítomen v koncentraci 0,1 až 0,5 ppm (mg/kg). V mořské vodě, kde se vyskytuje většina jodu přítomného na Zemi, dosahuje jeho koncentrace průměrné hodnoty 0,06 mg/l. Předpokládá se, že ve vesmíru na 1 atom jódu připadá 70 miliard atomů vodíku.
Základní surovinou pro výrobu jodu jsou mořské řasy, v jejichž pletivech se jod koncentruje. Oxidací jodidů, obsažených v popelu ze spálených řas, se získá elementární jod, který se rafinuje sublimací, tedy přeměnou látky z pevného do plynného skupenství. V plynném skupenství tvoří molekuly I2
Přírodní výskyt jodu jako minerálu je pochybný. Je uváděn bez dalších podrobnějších informací z Vesuvu a ostrova Vulcano (Liparské ostrovy) v Itálii.
Sloučeniny a využití

Roztok jodu ve směsi alkohol-voda je nazýván jodová tinktura a slouží v medicíně jako dezinfekční činidlo. Jod a jodid draselný se užívá k přípravě podobně účinkujícího Lugolova činidla. V poslední době se však jako antiseptikum obvykle používá šetrnější a stabilnější jodovaný povidon, což je komplex jodu a polyvinylpyrrolidonu.
Se škrobem stvoří intenzivně zbarvený modrý komplex, který v analytické chemii slouží jako důkaz jodu nebo polysacharidů. Tvorba zmíněného komplexu je využívána jako indikace bodu ekvivalence při jodometrických titracích, při nichž je základní reakcí oxidace thiosíranu sodného roztokem elementárního jódu.
Ve sloučeninách se jod vyskytuje v mocenství I−, I+, I3+, I5+ a I7+.
Praktický význam mají pouze některé jeho soli. Například nerozpustný jodid stříbrný, AgI, nachází využití ve fotografickém průmyslu.
S amoniakem tvoří jod velmi nestálou sloučeninu, jododusík, NI3, která se v suchém stavu explozivně rozkládá i při velmi slabém podnětu. Její praktické využití spadá spíše do oblasti chemických „žertů“.[4]
Zdravotní významnost
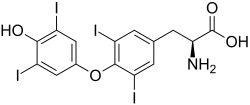
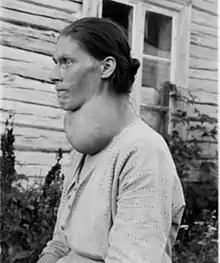
Jod patří mezi prvky nezbytné pro vývoj lidského organismu. Je součástí hormonů vylučovaných štítnou žlázou, z nichž nejdůležitější je thyroxin (viz strukturní vzorec). Skupina hormonů štítné žlázy ovlivňuje především vývoj pohybové soustavy a mozku v raných fázích vývoje, a proto může jejich nedostatek negativně ovlivnit inteligenci (kretenismus). Navenek se nedostatek jodu projevuje jako vole neboli struma.
Jod se obtížně stanovuje v krevním oběhu, kde jeho koncentrace je velice nízká a navíc extrémně kolísá podle příjmu potravy. Základní metodou saturace jodem je koncentrace jodu v moči. Umožňuje to fakt, že asi 80 % přijatého jodu se z organizmu vylučuje močí (zbytek v potu, dechu, stolici). Stanovuje se koncentrace jodu v moči (jodurie) v prvním ranním vzorku moči (což je metoda doporučovaná pro epidemiologický průzkum).
Protože jod je přítomen v mořské vodě, jsou mořské ryby a plody moře jeho dobrým zdrojem. Pro vegany jsou dobrými zdroji jodizovaná sůl (ačkoliv u té není snadné zjistit, na jaké úrovni je jodizovaná), mořské řasy a minerální doplňky. Jod je také ve zvýšené koncentraci přítomen v některých minerálních vodách. V současné době se uměle přidává do řady mléčných výrobků (jogurty, mléčné nápoje, mléčné krémy), které jsou pravidelně konzumovány dětmi. Obvykle se jedná o miligramová množství jodistanu sodného, která zajišťují pravidelný přísun potřebného množství jodu pro dospívající organizmus. Jodidové tablety dokáží v případě kritického stupně radiace zabránit poškození štítné žlázy, avšak mohou mít i vedlejší vážné zdravotní důsledky.
Primárně se jod nachází v mořských řasách, ale tam je jeho množství velice proměnlivé (Řasa Nori 16 μg/g, Wakame 42 μg/g, Kombu nazývaná také Kelp 2 353 μg/g, ). Více než 90 % jódu v mořských řasách je ve formě rozpustné ve vodě, tedy dobře využitelné lidským organismem. Doporučená denní dávka pro dospělé je 150 μg, pro těhotné ženy 220 μg a pro kojící ženy 290 μg.
Důkaz škrobu
Rozpuštěním jodu v ethanolu vznikne tmavěoranžová jodová tinktura. Po kápnutí tinktury na škrob (stačí rozemletá brambora) by se měl škrob obarvit do modrofialových odstínů.
Zajímavosti
Dnem jodu je 6. březen.
Odkazy
Poznámky
- Ve starší české literatuře se lze setkat též se značkou J.[2]
Reference
- Iodine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- CANOV, Michael. Archaické názvosloví prvků Presla, Jungmanna a Amerlinga v době národního obrození [online]. 2016-04-09 [cit. 2020-03-11]. (viz roky 1860, 1861). Dostupné online.
- (PDF) The concept of sublimation – iodine as an example. ResearchGate [online]. [cit. 2018-12-05]. DOI: http://dx.doi.org/10.1016/S0187-893X(17)30149-0. Dostupné online. (anglicky)
- KOUT, Rudolf. Navedení k chemickým pokusům. Ostrava: Knihovna přírody a školy, 1906. 176 s. Kapitola 39, s. 156.
Literatura
Externí odkazy
 Obrázky, zvuky či videa k tématu jod na Wikimedia Commons
Obrázky, zvuky či videa k tématu jod na Wikimedia Commons  Slovníkové heslo jód ve Wikislovníku
Slovníkové heslo jód ve Wikislovníku

