Plutonium
Plutonium (chemická značka Pu) je šestý člen z řady aktinoidů, druhý transuran, radioaktivní, řetězovou reakcí štěpitelný, toxický kovový prvek, připravovaný uměle bombardováním uranu v jaderných reaktorech, především pro výrobu atomových bomb. Je využitelné rovněž jako palivo pro jaderné reaktory a jako zdroj energie pro radioizotopový termoelektrický generátor.
| Plutonium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
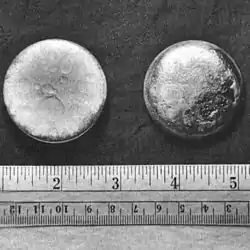
Malé kousky plutonia focené vůči pravítku s palcovou a centimetrovou škálou | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Plutonium, Pu, 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Plutonium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 7. perioda, blok f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Aktinoidy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 2×10−15 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | stříbrobílý kov | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 244,064 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 150 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 162 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | (Pu3+) 108 pm (Pu4+) 93 pm (Pu5+) 80 pm (Pu6+) 73 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Rn] 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | III, IV, V, VI, VII, VIII[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 5,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 13,0 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 23,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Čtvrtá | 39,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | α-modifikace jednoklonná β-modifikace jednoklonná tělesně centrovaná γ-modifikace kosočtverečná plošně centrovaná δ-modifikace krychlová plošně centrovaná δ´-modifikace čtverečná tělesně centrovaná ε-modifikace krychlová tělesně centrovaná | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 12,29×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota změny modifikace | 122 °C (α → β) 203 °C (β → γ) 317 °C (γ → δ) 453 °C (δ → δ´) 477 °C (δ´ → ε) °C (395,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 19,816 g/cm3 (mod. α, 21 °C) 17,77 g/cm3 (mod. β, 150 °C) 17,19 g/cm3 (mod. γ, 210 °C) 15,92 g/cm3 (mod. δ, 320 °C) 15,99 g/cm3 (mod. δ´, 465 °C) 16,48 g/cm3 (mod. ε, 500 °C) 16,185 g/cm3 (950 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Povrchové napětí | 550 ± 55 mN/m (při tt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 2 260 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | (0 °C) 6,16 W m−1 K−1 (25 °C) 6,70 W m−1 K−1 (77 °C) 7,90 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Součinitel délkové roztažnosti | 54×10−6 K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární atomizační entalpie | 364,4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní molární entropie S° | 51,5 J K−1 mol−1 (mod. α) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 641 °C (914,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 3 232 °C (3 505,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo tání | 2,828 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo varu | 333,5 kJ/mol (1 320 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpie změny modifikace ΔHα→β | 3,77 kJ/mol (α → β) 0,669 kJ/mol (β → γ) 0,619 kJ/mol (γ → δ) 0,042 kJ/mol (δ → δ´) 1,858 kJ/mol (δ´ → ε) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární tepelná kapacita | 36,99 J K−1 mol−1 (α mod., 67 °C) 34,31 J K−1 mol−1 (β mod., 200 °C) 37,02 J K−1 mol−1 (γ mod., 270 °C) 37,66 J K−1 mol−1 (δ mod.) 35,1 J K−1 mol−1 (ε mod.) 41,8 J K−1 mol−1 (kapalina, 675 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 141,4×10−8 Ω m (107 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota přechodu do supravodivého stavu | 0,5 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | (Pu3+ → Pu0) -2,031 V (Pu4+ → Pu3+) 1,006 V (Pu5+ → Pu4+) 1,099 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná magnetická susceptibilita | 2,52×10−6 cm3/g (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktivní | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Základní fyzikálně-chemické vlastnosti

Plutonium je radioaktivní kovový prvek stříbřitě bílé barvy, která se působením vzdušného kyslíku mění na šedavou. Čisté plutonium je podobně jako uran ve formě hoblin a pilin samozápalné, proto jeho zpracování vyžaduje extrémní opatrnost.
Ve sloučeninách se vyskytuje v mocenství od Pu+3 po Pu+7[1], přičemž stálejší jsou sloučeniny s nižší valencí. Soli plutonia vykazují v roztoku rozdílné zabarvení podle mocenství plutoniového iontu. Nejběžnější oxidační číslo plutonia je +IV a v tomto oxidační stupni vytváří plutonium amfoterní oxid plutoničitý PuO2. To znamená, že tento oxid se v roztocích kyselin rozpouští za vzniku plutoničitých solí a v zásadách za vzniku komplexního aniontu a vytváří plutoničitany. Plutoničité soli nejsou v roztocích úplně stabilní a částečně nebo úplně hydrolyzují, to je možno potlačit snížením pH (přidáním kyseliny) do roztoku.
Čistý kov lze připravit redukcí fluoridu plutonia kovovým lithiem nebo baryem při teplotě kolem 1200 °C.
Historie objevu
Plutonium bylo poprvé připraveno roku 1940 dvěma vědeckými týmy bombardováním 238U neutrony. V jaderné laboratoři v Berkeley na kalifornské univerzitě ho připravili Edwin M. McMillan a Philip Abelson a v britské Cambridgi ohlásili jeho přípravu Norman Feather a Egon Bretscher.
Příprava a izolace čistého kovu se uskutečnila 23. února 1941 v Berkeley bombardováním uranu jádry deuteria v cyklotronu. Jako autoři tohoto experimentu jsou označováni Glenn T. Seaborg, Edwin McMillan, J. W. Kennedy a A. C. Wahl. Vzhledem k probíhající druhé světové válce byly výsledky tohoto bádání udržovány v tajnosti, zvláště proto, že jedna ze dvou atomových bomb svržených USA na Japonsko byla vyrobena právě z plutonia.
Výskyt a izotopy
Plutonium patří mezi uměle připravené prvky a v přírodě je možné se setkat jen se skutečně ultrastopovými množstvími v uranových rudách, kde mohou jednotlivé atomy vzniknout z 238U po záchytu neutronu a následných dvou rozpadech β.
Mezi 20 známými izotopy plutonia existuje několik, které vykazují dostatečně velký poločas rozpadu, aby je bylo možno prakticky využít. Nejdelší poločas (asi 80 milionů let) má 244Pu, nejdůležitější izotop 239Pu se rozpadá s poločasem 24 110 let, 240Pu 6561 let, 241Pu 14,325 roků, 242Pu 375 000 let a 238Pu má poločas rozpadu 87,7 let; existuje však celá řada dalších izotopů:
| Izotop | poločas rozpadu | druh rozpadu | produkt rozpadu |
|---|---|---|---|
| 228Pu | 1,1 s | α | 224U |
| 229Pu | 67 s | α (50 %) / ε (50 %) | 225U / 229Np |
| 230Pu | 102 s | α | 226U |
| 231Pu | 8,6 min | ε (90 %) / α (10 %) | 231Np / 227U |
| 232Pu | 33,8 min | ε (90 %) / α (10 %) | 232Np / 228U |
| 233Pu | 20,9 min | ε (99,88 %) / α (0,12 %) | 233Np / 229U |
| 234Pu | 8,8 h | ε (94 %) / α (6 %) | 234Np / 230U |
| 235Pu | 25,3 min | ε (100,00 %) / α (2,8×10−3 %) | 235Np / 231U |
| 236Pu | 2,858 r | α (100 %) / SF (1,9×10−7 %) | 232U / různé |
| 237Pu | 45,64 d | ε (100,00 %) / α (4,2×10−3 %) | 237Np/ 233U |
| 238Pu | 87,7 r | α (100 %) / SF (1,9×10−7 %) | 234U / různé |
| 239Pu | 24 110 r | α / SF (3×10−10 %) | 235U / různé |
| 240Pu | 6 561 r | α / SF (5,7×10−6 %) | 236U / různé |
| 241Pu | 14,329 r | β− (100,00 %)/ α (2,5×10−3 %) SF (<2×10−14 %) | 241Am / 237U / různé |
| 242Pu | 375 000 r | α (100 %)/ SF (5,5×10−4 %) | 238U / různé |
| 243Pu | 4,956 h | β− | 243Am |
| 244Pu | 8×107 r | α (99,88 %) / SF (0,12 %) | 240U / různé |
| 245Pu | 10,5 h | β− | 245Am |
| 246Pu | 10,84 d | β− | 246Am |
| 247Pu | 2,27 d | β− | 247Am |
Výroba a využití
Jaderné zbraně

Plutonium je od 40. let 20. století nejvíce vyráběným umělým prvkem a to především proto, že izotop 239Pu je vhodný pro výrobu atomové bomby. Stejně jako v případě 235U dochází při nahromadění větších kvant čistého izotopu k nastartování řetězové štěpné reakce, kdy po rozpadu jednoho atomového jádra vznikají obvykle tři neutrony, které působí rozpady dalších okolních jader a rozpad se nekontrolovaně rozrůstá. Kritické množství čistého kovového plutonia 239Pu je přibližně 10,5 kg, s použitím neutronového odrážeče lze toto množství snížit až kolem 2,5 kg. Plutoniová jaderná puma má sílu výbuchu přibližně 20 kilotun TNT na každý kilogram rozštěpeného plutonia.
Princip výroby 239Pu spočívá v reakci 238U s neutronem za vzniku 239U v jaderném reaktoru. Jádro 239U je značně nestabilní a rozpadem β rychle vzniká izotop neptunia 239Np, jež se opět rychle dalším β-rozpadem mění na 239Pu. Tento izotop plutonia se chová jako α zářič a relativně snadno se dále zpracovává.
- 238
92 U + 1
0 n → 239
92 U → 239
93 Np + 0
−1 e → 239
94 Pu + 0
−1 e
Při výrobě izotopu 238Pu se uran 238U bombarduje jádry deuteria:
- 238
92 U + 2
1 D → 238
93 Np + 2 1
0 n → 238
94 Pu + 0
−1 e
V případě, že jádro 239Pu zachytí další neutron, dojde k jeho přeměně na 240Pu. Tento izotop je z hlediska další manipulace a zpracování rizikový protože je β–zářičem a zároveň není vhodný pro výrobu atomové zbraně. Protože izotopy 239Pu a 240Pu lze jen velmi obtížně oddělovat, je při výrobě 239Pu z 238U v jaderném reaktoru nutno pečlivě volit dobu setrvání 238U v reaktoru. Při dlouhodobém ozařování sice roste množství 239Pu, ale současně narůstá i podíl nechtěného izotopu 240Pu. Na druhé straně je ekonomicky značně nákladné oddělovat izotopy plutonia od zbytku jaderného paliva z reaktoru a je proto otázkou komplikovaných výpočtů určit, v jakém stádiu výroby má být reakce přerušena a materiál chemicky přepracován na čisté plutonium. Další důležitou proměnnou veličinou je zde pochopitelně i procentuální vsázka 238U do jaderné reakce.
Další využití
- Podobně jako v případě uranu může být řetězová reakce, v níž po záchytu neutronu dojde k rozpadu atomového jádra prvku za uvolnění dalších neutronů a kinetické energie štěpných produktů, využita i pro výrobu energie v upravených jaderných reaktorech. V současné době pracuje na světě několik jaderných reaktorů na bázi směsi 239Pu a 240Pu, obecně jsou však tyto reaktory pokládány za méně bezpečné než klasické uranové vzhledem k vysoké toxicitě plutonia a jeho sloučenin.
- Izotop 238Pu s poločasem rozpadu 88 let slouží často jako energetický zdroj především v kosmických sondách. V tzv. radioizotopovém termoelektrickém generátoru se mění tepelná energie uvolněná samovolným jaderným rozpadem na elektrickou pomocí termočlánků. Pro tyto účely jsou vhodné izotopy s poločasem rozpadu v řádu desítek let, protože uvolněná energie je dostatečně velká, aby mohla být prakticky využita a zároveň zaručuje použitelnost zdroje po dobu minimálně 50 let. Produkovaný výkon generátoru dosahuje stovek wattů, což postačuje pro udržení provozu základních elektrických přístrojů vesmírné sondy. Plutoniové generátory zásobují energií např. sondy Galileo nebo Cassini a udržovaly několik let v provozu vědecké přístroje, zanechané na Měsíci kosmonauty v rámci projektu Apollo. 238PuO2 byl použit také jako palivo pro sondu New Horizons.
- Spíše jako zajímavost může sloužit informace, že výše uvedené generátory elektrické energie v některých případech slouží jako energetický zdroj pro kardiostimulátory, medicínské přístroje sloužící ke zklidnění srdečního rytmu u osob s rizikem infarktu. V současné době jsou pro tyto účely používány především lithiové baterie s dlouhou životností a indukčním dobíjením, ale před jejich vynálezem byl energetický zdroj fungující na principu jaderného rozpadu 238Pu přijatelnou alternativou.
Zdravotní rizika
Plutonium je jako těžký kov extrémně toxický, v praxi lze však u něho těžko rozlišit škodlivé účinky způsobené radiací od škodlivých účinků chemických; je často pokládáno za jednu z nejtoxičtějších anorganických látek. Podle některých údajů mohou být už mikrogramová množství tohoto prvku smrtelně jedovatá pro člověka, pokud se dostanou do krevního oběhu. Jiné zdroje však považují údaje o extrémní toxicitě plutonia za nadhodnocené. J. Marhold cituje z prací, kde je uvedena dávka LD50 u psa i. v. 0,3 mg/kg. Toxikologie zná i mnohem prudší jedy. Za hlavní nebezpečí se považuje depozice v kostech.
Radiačně nebezpečný je především izotop 241Pu, který jako β-zářič má daleko negativnější dopad na lidské zdraví než zbylé izotopy plutonia, zářiče α. Je pochopitelné, že mimořádné nebezpečí by hrozilo při nastartování řetězové štěpné reakce, kdy se plutonium stává zdrojem silného neutronového toku. K tomu však může dojít pouze při neopatrné manipulaci s většími objemy čistého plutonia; v počátcích výzkumu plutonia v laboratořích v Berkeley skutečně několikrát došlo k vysoké expozici pracovníků neutrony, konkrétně nehody při experimentech s kritickým množstvím, 21. srpna 1945 nehoda Harryho K. Daghliana Jr. (1921–1945) a 21. května 1946 nehoda Louise P. Slotina (1910–1946). Při těchto nehodách došlo k vysokému ozáření menšího počtu osob, H. K. Daghlian zemřel 26 dní po nehodě, L. P. Slotin po 9 dnech.
Odkazy
Reference
Literatura
- Cotton F. A., Wilkinson J.: Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.: Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood, A. Earnshaw, Chemie prvků II. 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu plutonium na Wikimedia Commons
Obrázky, zvuky či videa k tématu plutonium na Wikimedia Commons  Slovníkové heslo plutonium ve Wikislovníku
Slovníkové heslo plutonium ve Wikislovníku- Co je smíšené oxidové palivo (MOX) a kde se používá? Archivováno 27. 9. 2007 na Wayback Machine, Česká nukleární společnost, Zpravodaj 2/2000
- (anglicky) IARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS, VOLUME 78 IONIZING RADIATION, PART 2: SOME INTERNALLY DEPOSITED RADIONUCLIDES IARC 2001,
- (česky) Novinky.cz - Izrael vyvinul plutonium, které nelze použít na atomovou bombu