Titan (prvek)
Titan (chemická značka Ti, latinsky Titanium) je šedý až stříbřitě bílý, lehký kov, poměrně hojně zastoupený v zemské kůře. Je poměrně tvrdý a mimořádně odolný proti korozi i ve slané vodě. Při teplotách pod 0,39 K se stává supravodičem I. typu. Jeho výrazně většímu technologickému uplatnění brání doposud vysoká cena výroby čistého kovu. Hlavní uplatnění nalézá jako složka různých slitin a protikorozních ochranných vrstev, ve formě chemických sloučenin slouží často jako složka barevných pigmentů.
| Titan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Titan, Ti, 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Titanium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 4. skupina, 4. perioda, blok d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Přechodné kovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 5 700 až 6 300 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 0,001 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Šedý až stříbřitě bílý, lehký kov | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-32-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 47,867 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 147 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 160 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | 68 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Ar] 3d2 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | I, II, III, IV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 658,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 1309,8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 2652,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Čtvrtá | 4324 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Hexagonální | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 10,64×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 4,506 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdost | 6,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak syté páry | 100 Pa při 2403K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 5290 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 21,9 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 1667,85 °C (1 941 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 3286,85 °C (3 560 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 14,15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo varu | 425 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 523 Jkg−1K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 2,38×106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 420 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | −1,63 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | Paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Nebezpečí[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-věty | R17, R36/37/38 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-věty | S26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Objev prvku
Titan byl objeven roku 1791 anglickým chemikem Williamem Gregorem v minerálu ilmenitu a poprvé pojmenován Martinem H. Klaprothem roku 1795. Izolován byl až v roce 1910 M. A. Hunterem zahříváním chloridu titaničitého TiCl4 s kovovým sodíkem v ocelové tlakové nádobě.
Základní fyzikálně-chemické vlastnosti

Titan je šedý až stříbřitě bílý, lehký a tvrdý kov. Je dobrým vodičem tepla i elektřiny. Vyznačuje se mimořádnou chemickou stálostí – je zcela netečný k působení vody a atmosférických plynů a odolává působení většiny běžných minerálních kyselin i roztoků alkalických hydroxidů. Zvolna se rozpouští v horké kyselině chlorovodíkové, naopak kyselina dusičná jeho povrch pasivuje. Pro jeho rozpouštění je nejúčinnější kyselina fluorovodíková nebo její směsi s jinými minerálními kyselinami.
Za zvýšených teplot však titan přímo reaguje s většinou nekovů, například s vodíkem, kyslíkem, dusíkem, uhlíkem, borem, křemíkem, sírou a halogeny.
Ve sloučeninách se vyskytuje v mocenství TiIII a TiIV. Sloučeniny čtyřmocného titanu jsou neomezeně stálé, sloučeniny TiIII jsou silnými redukčními činidly a působením vzdušného O2 rychle přecházejí na TiIV.
Výskyt a výroba
Titan je sedmým nejrozšířenějším kovem v zemské kůře, jeho obsah je odhadován na 5,7 – 6,3 g/kg. V mořské vodě je díky své chemické stálosti přítomen pouze v koncentraci 0,001 mg/l. Ve vesmíru připadá na jeden atom titanu 1 milion atomů vodíku.
V malém množství je titan obsažen ve většině minerálů a mezi jeho nejvýznamnější rudy patří ilmenit – (FeTiO3 oxid železnato-titaničitý) a rutil (TiO2 – oxid titaničitý). Významné zásoby těchto minerálů se nacházejí v Austrálii, Severní Americe, Skandinávii a Malajsii. Významně je titan zastoupen i na měsíčním povrchu – horniny, které získala mise Apollo 17 obsahují přibližně 12 % TiO2.
Přes své vysoké zastoupení v zemské kůře byl čistý kovový titan po dlouhou dobu velmi vzácným a drahým materiálem. Důvodem je skutečnost, že běžné hutní metody, které se využívají k výrobě jiných kovů, jsou v případě titanu neúčinné díky ochotě titanu reagovat za zvýšené teploty s kyslíkem, vodíkem, uhlíkem a dusíkem.
V současné době se při průmyslové výrobě titanu používá především tzv. Krollův proces. Přitom se nejprve pyrolýzou ilmenitu nebo rutilu s uhlíkem a chlorem získává chlorid titaničitý TiCl4. Po přečištění se jeho páry redukují hořčíkem v inertní argonové atmosféře při teplotě kolem 800 °C.
- TiCl4 + 2 Mg → Ti + 2 MgCl2
Titan vzniklý touto reakcí je tuhá, pórovitá látka, která se po odstranění chloridu hořečnatého a nezreagovaného hořčíku dále čistí.
Použití
Praktické využití elementárního titanu vyplývá především z jeho mimořádné chemické odolnosti a malé hustoty. Je přitom třeba vzít v úvahu, že výroba titanu je v současné době relativně značně finančně náročná a provozní nasazení titanových komponentů je účelné pouze v případech, kdy není možno použít levnější alternativu na bázi slitin hliníku a hořčíku – duralů.
Již od počátku průmyslové výroby kovového titanu spočívalo těžiště jeho využití v kosmických technologiích a speciálních aplikacích leteckého průmyslu. Titan a jeho slitiny jsou proto základním materiálem při výrobě skeletů nebo povrchových ochranných štítů kosmických objektů (družice, vesmírné sondy a vesmírné stanice). V leteckém průmyslu nacházejí využití při výrobě zvláště namáhaných součástí letadel, tedy především při konstrukci vojenských stíhacích letounů a dnes i při konstrukci komerčních dopravních letounů.
Díky své vysoké chemické netečnosti se titan v okolním prostředí nevyskytuje v takové formě, která by mohla být metabolizována živými organizmy. Není proto známo žádné zapojení titanu do enzymatických reakcí nebo jejich jiné biologické uplatnění.
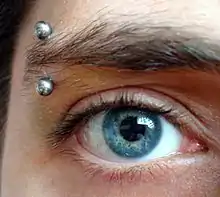
Naopak vysoká odolnost titanu je využívána při výrobě některých chirurgických nástrojů a v současné době jsou módní piercingové ozdoby pokryté titanem pro jejich zdravotní nezávadnost a současně žádaný vzhled.
Titan, ve formě čistého titanu nebo titanové slitiny (Ti-6Al-4V) se používá jako implantát za kostní tkáně v ortopedii, neurochirurgii, stomatologii, nebo v obličejové a plastické chirurgii. V současnosti je titan preferován zejména pro fyzikálně-chemické vlastnosti, mechanickou pevnost a dobrou korozivzdornost.[2]
V chemickém průmyslu je titan stále populárnějším materiálem pro výrobu nebo pouhou vystýlku chemických reaktorů, které pracují v extrémních podmínkách a vyžadují vysokou odolnost proti korozi.
Titan je stále častěji používán v zařízeních, která dlouhodobě pracují ve styku s mořskou vodou. Mohou to být součásti lodí nebo ponorek (lodní šrouby), ale i komponenty průmyslových celků, sloužících k odsolování (desalinaci) mořské vody.
V běžném každodenním životě se s titanem můžeme setkat například jako s materiálem pro výrobu luxusních náramkových hodinek nebo částí šperků. Titan se používá těž na výrobu golfových holí, kvalitních sluchátek nebo u luxusních jízdních kol kde se používají titanové šrouby.
USA v období „studené války“ ještě nezvládaly technologii průmyslové výroby titanu, proto nakupovaly tento materiál pomocí prostředníků od SSSR. Příkladem je například špionážní letoun SR-71, jehož drak je kompletně vyroben z titanu nakoupeného v tehdejším Sovětském svazu. (Zdroj: americký dokument „Letadla, která změnila svět 1“, Arrow International media Ltd. and Smithsonian Networks L.L.C).[zdroj?]
Sloučeniny
Ve sloučeninách se titan vyskytuje v mocenství TiIII a TiIV, z nichž pouze sloučeniny čtyřmocného titanu jsou neomezeně stálé.
- Prakticky nejvýznamnější sloučeninou titanu je oxid titaničitý TiO2. Je to velmi stabilní sloučenina, která se v krystalickém stavu vyskytuje ve 3 krystalických modifikacích, kterým odpovídají 3 různé minerály – rutil, anatas a brookit. Pro praktické použití je však nejvíce vhodná amorfní prášková forma, nazývaná titanová běloba. Tento bílý pigment je mimořádně stálý, zdravotně zcela nezávadný s vysokou krycí schopností a patří proto mezi nejkvalitnější dostupné bílé pigmenty. Praktické použití nachází jak při výrobě barev, tak ve sklářském a keramickém průmyslu, používá se i při výrobě vysoce kvalitního papíru, jako plnivo při výrobě plastických hmot a někteří výrobci jej přidávají i do zubních past. Díky tomu, že prochází trávicím traktem nepozměněn, je používán i v potravinářském průmyslu k bělení mléka. Odhaduje se, že oxid titaničitý tvoří více než 90 % celosvětové spotřeby produktů z titanu.
- Chlorid titaničitý TiCl4 je bezbarvá kapalina o bodu varu 137 °C. Je základním meziproduktem při přípravě čistého titanu Krollovým procesem. Při kontaktu s atmosférickou vlhkostí dochází k jeho postupné hydrolýze podle rovnice:
- TiCl4 + 2 H2O → TiO2 + 4 HCl
- Vznikající TiO2 vytváří intenzivní bílý dým, který není prakticky toxický. Uvedený jev nachází využití v pyrotechnice při výrobě zadýmovacích granátů, při vytváření umělé mlhy (například při natáčení filmů) nebo při leteckých show.
- TiCl4 také slouží jako katalyzátor (Ziegler-Natta. NP v roce 1963) při polymeracích nenasycených uhlovodíků.
- Chlorid titanitý TiCl3 se používá v titanometrii. Má redukční účinky. Lze taktéž použít jako Ziegler-Nattův katalyzátor.
- Nitrid titanu (TiN) patří k jedněm z nejtvrdších známých látek, její tvrdost je 9 na 10stupňové Mohsově stupnici tvrdosti. Jeho aplikací jsou brusné materiály, ale i povlakování nástrojů, kdy je na povrchu nástroje určeného pro extrémní fyzické namáhání vytvořena tenká ochranná vrstva TiN.
- Karbid titanu (TiC) má podobné vlastnosti jako TiN a spolu s ním je využíván při výrobě cermetů i k povlakování nástrojů.
- Superpružné Ti-Cu slitiny. Drát z této slitiny lze ohnout do pravého úhlu, přičemž nedochází k plastické deformaci.
- Slitiny s tvarovou pamětí Ni-Ti. Drát z této slitiny si „pamatuje“ předchozí stav před deformací. Po dodání energie (ohřevu) se vrací do původního tvaru.
 Titanová houba získaná Krollovým procesem
Titanová houba získaná Krollovým procesem_mit_sichtbarer_Kristallstruktur.jpg.webp) Vysoce čistý titan s viditelnými krystaly
Vysoce čistý titan s viditelnými krystaly Náramkové hodinky vyrobené z titanu
Náramkové hodinky vyrobené z titanu Vrták povlakovaný nitridem titanu
Vrták povlakovaný nitridem titanu
Odkazy
Reference
- Titanium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Březovská I.: Bakalářská práce. VŠCHT, Praha 2007
Literatura
- Cotton F.A., Wilkinson J.: Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.: Analytická chemie, SNTL, Praha 1974
Externí odkazy
 Obrázky, zvuky či videa k tématu titan na Wikimedia Commons
Obrázky, zvuky či videa k tématu titan na Wikimedia Commons  Slovníkové heslo titan ve Wikislovníku
Slovníkové heslo titan ve Wikislovníku- (česky) Chemický vzdělávací portál
- Metal of the gods

