Organické sloučeniny fosforu
Organické sloučeniny fosforu jsou organické sloučeniny obsahující fosfor.[1] Nejčastěji se používají jako náhrada pesticidů tvořených chlorovanými uhlovodíky, které se hromadí v životním prostředí. Některé organické sloučeniny fosforu jsou účinnými insekticidy, jiné, například sarin a VX, jsou silnými neurotoxiny.[2]
Vlastnostmi těchto sloučenin se zabývá organofosforová chemie. Fosfor, podobně jako dusík, patří mezi pniktogeny, tedy prvky 15. skupiny periodické tabulky, a tak mají sloučeniny fosforu a dusíku mnoho podobných vlastností.[3][4][5] Definice organofosforových sloučenin se mohou lišit. V průmyslu a chemii životního prostředí se jimi rozumí všechny sloučeniny fosforu obsahující organické funkční skupiny, ovšem nemusí obsahovat přímé vazby mezi fosforem a uhlíkem (P-C).[zdroj?] a řadí se sem tak i mnohé pesticidy, jako například malathion), neobsahující vazby C-P.
Fosfor se může ve sloučeninách vyskytovat v několika oxidačních číslech, jeho organické sloučeniny se často dělí podle toho, jestli se v nich nachází PV nebo PIII (tyto dvě skupiny sloučenin jsou nejobvyklejší). Sloučeniny fosforu lze také dělit podle jejich koordinačních čísel σ a valencí λ. Fosfan je podle tohoto značení σ3λ3 sloučenina.
Fosforečné sloučeniny a jejich hlavní skupiny
Fosfátové estery a amidy
Fosfátové estery mají obecný vzorec P(=O)(OR)3 s pětimocným fosforem. Některé mají význam jako zpomalovače hoření a plastifikátory. Protože neobsahují vazby P−C, tak technicky vzato nepatří mezi organofosforečné sloučeniny, ale mezi estery kyseliny fosforečné. Mnoho těchto látek, například fosfatidylcholin, se vyskytuje v přírodě. Fosfátové estery se vyrábí alkoholýzou oxychloridu fosforečného.
Také je známa řada smíšených amido-alkoxoderivátů, například protinádorové léčivo cyklofosfamid. Byly popsány i varianty obsahující thiofosforylové skupiny (P=S), jako pesticid malathion. Nejvíce vyráběnými organofosfáty jsou dithiofosforečnany zinečnaté a některá aditiva do motorových olejů. Ročně se vyrobí několik tisíc tun těchto komplexních sloučenin reakcemi sulfidu fosforečného s alkoholy.[6]
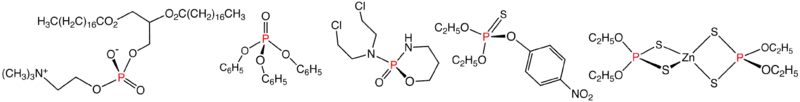 Příklady organofosfátů a příbuzných sloučenin: fosfatidylcholin, trifenylfosfát, cyklofosfamid, parathion a dithiofosforečnan zinečnatý
Příklady organofosfátů a příbuzných sloučenin: fosfatidylcholin, trifenylfosfát, cyklofosfamid, parathion a dithiofosforečnan zinečnatý
V životním prostředí jsou tyto sloučeniny rozkládány hydrolýzou na fosforečnany a alkoholy či aminy, od kterých jsou odvozeny.
Fosfonové a fosfinové kyseliny a jejich estery
Fosfonáty jsou estery kyseliny fosfonové, mají obecný vzorec RP(=O)(OR')2. Tyto sloučeniny nacházejí řadu technických využití, například jako herbicid glyfosát, známější jako Roundup; jeho vzorec je (HO)2P(O)CH2NHCH2CO2H, jedná se o derivát glycinu. Bisfosfonáty se používají jako léky na osteoporózu. Mezi fosfonáty patří rovněž neurotoxin sarin, v jehož molekulách jsou přítomny vazby C–P i F–P.
Fosfináty obsahují dvě vazby P–C a jejich obecný vzorec je R2P(=O)(OR'). Významným zástupcem této skupiny je herbicid glufosinát, se strukturou podobnou glyfosátu - CH3P(O)(OH)CH2CH2CH(NH2)CO2H.
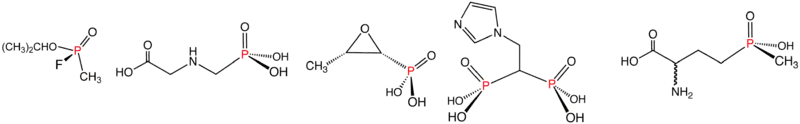 Příklady fosfonátů a fosfinátů: sarin (fosfonát), glyfosát (fosfonát), fosfomycin (fosfonát), kyselina zoledronová (fosfonát) a glufosinát (fosfinát). Ve vodných roztocích vytvářejí fosfonové kyseliny příslušné organofosfonáty.
Příklady fosfonátů a fosfinátů: sarin (fosfonát), glyfosát (fosfonát), fosfomycin (fosfonát), kyselina zoledronová (fosfonát) a glufosinát (fosfinát). Ve vodných roztocích vytvářejí fosfonové kyseliny příslušné organofosfonáty.
Nejpoužívanějším způsobem přípravy a výroby těchto sloučenin je Michaelisova–Arbuzovova reakce, například dimethylmethylfosfonát vzniká z trimethylfosfitu, přesmykem katalyzovaným jodmethanem. V Hornerově–Wadsworthově–Emmonsově reakci a Seyferthově–Gilbertově homologaci reagují fosfonáty s karbonylovými sloučeninami. Kabačnikova–Fieldsova reakce představuje metodu přípravy aminofosfonátů, u kterých je vazba fosfor-uhlík značně nereaktivní. Jejich hydrolýzou tak vznikají deriváty fosfonových a fosfinových kyselin, ne však fosforečnany.
Fosfinoxidy, imidy a chalkogenidy
Fosfinoxidy (označení σ4λ5) mají obecnou strukturu R3P=O s fosforem v oxidačním čísle V. Fosfinoxidy vytváří vodíkové vazby a některé jsou tak rozpustné ve vodě. Vazba P=O je velmi polární, s dipólovým momentem 4,51 D u trifenylfosfinoxidu.
Podobnými sloučeninami jako fosfinoxidy jsou ostatní chalkogenidy (R3PE, kde E = S, Se nebo Te) a fosfinimidy (R3PNR'). Tyto sloučeniny patří k tepelně nejstálejším organickým sloučeninám fosforu.
Fosfoniové soli a fosforany
Sloučeniny se vzorcem [PR4+]X− se nazývají fosfoniové soli. Jedná se o sloučeniny PV. Komerčně nejvýznamnějším zástupcem této skupiny je Tetrakis(hydroxymethyl)fosfoniumchlorid, [P(CH2OH)4]Cl, používaný jako zpomalovač hoření u textilií.Ročně se vyrobí kolem 2000 tun chloridu a podobného sulfátu.[6] Tyto sloučeniny se vyrábějí reakcemi fosfinů s formaldehydem za přítomnosti minerální kyseliny:
- PH3 + HX + 4 CH2O → [P(CH2OH)4+]X−
Řadu různých fosfoniových solí je možné připravit alkylacemi či arylacemi fosfinů:
- PR3 + R'X → [PR3R'+]X−
Methylace trifenylfosfinu je prvním krokem při výrobě Wittigových činidel.
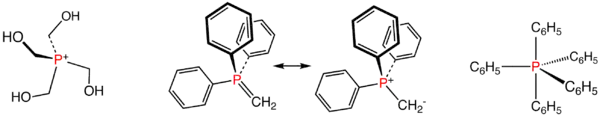 Příklady organofosforečných sloučenin: fosfoniový ion P(CH2OH)4+, dvě rezonanční struktury Wittigova činidla Ph3PCH2 a pentafenylfosforan
Příklady organofosforečných sloučenin: fosfoniový ion P(CH2OH)4+, dvě rezonanční struktury Wittigova činidla Ph3PCH2 a pentafenylfosforan
Základní sloučeninou je zde fosforan (σ5λ5) (PH5), jenž není znám.
Podobné sloučeniny s halogenidy a organickými substituenty na fosforu byly také popsány. Sloučeniny obsahující pět organických substituentů jsou vzácné, znám je však P(C6H5)5, odvozený od P(C6H5) +
4 reakcí s fenyllithiem.
Ylidy fosforu jsou nenasycené fosforany, Označují se jako Wittigova činidla; příkladem může být CH2P(C6H5)3. Mají tetraedrická PV centra a jsou považovány za příbuzné fosfinoxidům. Také se připravují z fosfoniových solí, ovšem deprotonací namísto alkylace.
Organofosforité sloučeniny a jejich hlavní skupiny
Fosfity, fosfonity a fosfinity
Fosfity mají obecný vzorec P(OR)3 s fosforem v oxidačním čísle +3. Vznikají alkoholýzou chloridu fosforitého:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
Je známo velké množství těchto sloučenin. Fosfity se zapojují do Perkowových a Michaelisových–Arbuzovových reakcí. Také se používají jako ligandy v organokovové chemii.
Mezistupněm mezi fosfity a fosfiny jsou fosfonity (P(OR)2R') a fosfinity (P(OR)R'2). Tyto sloučeniny se připravují alkoholýzou příslušného chloridu (PClR'2 u fosfonitů a PCl2R' u fosfinitů).
Fosfiny
Fosfiny jsou odvozeny od fosfanu (PH3).[7] Nahrazením jednoho nebo více vodíků organickými substituenty (alkyly nebo aryly) vznikají (organo)fosfiny PH3−xRx.
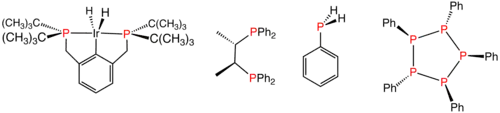 Různé redukované organické sloučeniny fosforu: komplex fosfinového ligandu, chirální difosfin používaný jako homogenní katalyzátor, primární fosfin PhPH2 a sloučenina (PPh)5, obsahující fosfor s oxidačním číslem 1
Různé redukované organické sloučeniny fosforu: komplex fosfinového ligandu, chirální difosfin používaný jako homogenní katalyzátor, primární fosfin PhPH2 a sloučenina (PPh)5, obsahující fosfor s oxidačním číslem 1
Porovnání fosfinů a aminů
Atom gfosforu ve fosfinech a fosforových analozích aminů má oxidační číslo −3 (σ3λ3). Podobně jako aminy mají fosfiny trigonálně pyramidovou molekulovou geometrii, i když s menšími úhly C-E-C angles (E = N, P), přinejmenším za nepřítomnosti sterických efektů. Vazebný úhel C-P-C [je u trimethylfosfinu 98,6°, při nahrazení methylových skupin terc-butylovými jde o 109,7°. Míru působení sterických efektů u fosfinů použitých jako ligandy lze vyjádřit pomocí jejich Tolmanova úhlu. Bariéra pyramidální inverze je zde mnohem vyšší, než u dusíkatých analogů. Fosfiny jsou často slabšími zásadami než odpovídající aminy, například základní fosfoniový ion má pKa −14, zatímco u amonného kationtu jde o 9,21; trimethylfosfonium vykazuje pKa 8,65 a trimethylamonium pouze 9.76. Trifenylfosfin (pKa 2,73) je ovšem zásaditější než trifenylamin (pKa −5), částečně proto, že volný elektronový pár na dusíku u NPh3 je částečně delokalizován na třech fenylových kruzích. U pyrrolu je volný elektronový pár delokalizován, u atomu fosforu ve fosforitém analogu (fosfolu) není. Reaktivita fosfinů v porovnání s aminy je v souladu s nukleofilitou fosfoniových solí, jejichž obecný vzorec je PR4+X−. Tato vlastnost se využívá při Appelových reakcích k přeměně alkoholů na alkylhalogenidy. Fosfiny se snadno oxidují na fosfinoxidy, zatímco tvorba aminoxidů je obtížnější. Z toho důvodu jsou fosfiny v přírodě velmi vzácné.
Výroba a příprava
Průmyslově nejvýznamnějším fosfinem je trifenylfosfin, kterého se vyrábí několik tisíc tun ročně. Získává se reakcí chlorbenzenu, chloridu fosforitého a sodíku.[6] „Specializované“ fosfiny jsou obvykle vyráběny jinými postupy.[8] Halogenidy fosforu vstupují do nukleofilních substitučních reakcí s organokovovými sloučeninami, jako jsou Grignardova činidla. Některé syntézy fosfinů využívají nukleofilní odštěpení organofosfidových aniontů ("R2P−") pomocí aryl- a alkylhalogenidů. Primární (RPH2) a sekundární fosfiny (R2PH) se adují na alkeny za přítomnosti silných zásad (například hydroxidu draselného v dimethylsulfoxidu). Reakce probíhají podle Markovnikovova pravidla. Podobně mohou reagovat i s alkyny.[9] U alkenů a alkynů s nedostatkem elektronů (jako jsou deriváty akrylonitrilu) nejsou potřeba zásady.
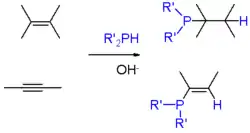 Adice fosfinů na alkeny a alkyny
Adice fosfinů na alkeny a alkyny
Za podmínek vhodných pro radikálové adice lze adovat vazby P-H primárních a sekundárních fosfinů na alkeny. Regiochemie těchto reakcí bývají proti Markovnikovovu pravidlu. Jako iniciátory se používají azobisisobutyronitril (AIBN) nebo organické peroxidy. Terciární fosfinoxidy a fosfinsulfidy mohou být redukovány například chlorsilany.
Reakce
Organofosfiny mohou být použity jako nukleofily a ligandy. Nejvíce nacházejí využití ve Wittigových reakcích a jako složky homogenních katalyzátorů společně s fosfinovými ligandy.
Nukleofilitu těchto sloučenin lze ukázat na jejich reakcích s alkylhalogenidy, jimiž vznikají fosfoniové soli. Fosfiny mají využití jako nukleofilní katalyzátory v organické syntéze, například v Rauhutových–Currierových a Baylisových–Hillmanových reakcích.
Fosfiny jsou redukční činidla, této jejich vlastnosti se využívá například při Staudingerových reakcích, kde se přeměňují organické azidy na aminy, a v Micunobových reakcích, převádějících alkoholy na estery. V těchto reakcích se trojmocný fosfor oxiduje na pětimocný. Fosfiny také mohou redukovat aktivované karbonylové sloučeniny, například α-ketoestery na α-hydroxyestery.[10] V navrženém reakčním mechanismu se na začátku přesouvá proton z methylové skupiny trimethylfosfinu (trifenylfosfin nereaguje).
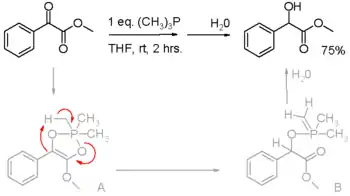 Redukce aktivovaných karbonylů pomocí alkylfosfinů
Redukce aktivovaných karbonylů pomocí alkylfosfinů
Primární a sekundární fosfiny
Mimo jiné reakce spojované s fosfiny vykazují ty, které obsahují vazby P-H, další reaktivitu, která s těmito vazbami souvisí. Silné zásady je snadno deprotonují na organofosfidové anionty. Primární a sekundární fosfiny se připravují redukcemi příslušných fosforečných halogenidů nebo esterů, primární lze rovněž získat redukcí fosfonátů, například:[11]
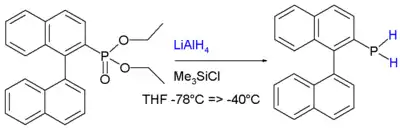
Výše zobrazené binaftylové primární fosfiny jsou stálé na vzduchu, pravděpodobně díky vysoké míře konjugace v binaftylovém řetězci.[12] Stejným způsobem lze vysvětlit i stabilitu prvního známého fluorescentního primárního fosfinu, BodPH2.[13]
Fosfaalkeny a fosfaalkyny
Sloučeniny s vícenásobnými vazbami mezi atomy uhlíku a fosforu se nazývají fosfaalkeny, pokud je tato vazba dvojná (R2C=PR) a fosfaalkyny, pokud jde o trojnou vazbu (RC≡P). Příkladem může být fosforin, sloučenina odvozená od benzenu náhradou jednoho atomu uhlíku fosforovým; jde tedy o analog pyridinu.
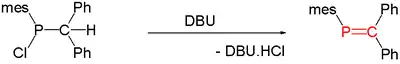
Tyto sloučeniny jsou vzácné, ovšem stávají se předměty výzkumů. Fosfaalkeny se připravují 1,2-eliminacemi z vhodných prekurzorů, reakce bývají spouštěny teplem nebo zásadami, jako jsou například 1,8-diazabicyklo(5.4.0)undec-7-en (DBU), 1,4-diazabicyklo(2.2.2)oktan (DABCO) nebo triethylamin:
Termolýzou Me2PH vzniká nestabilní CH2=PMe.
Sloučeniny P0, PI a PII
Sloučeniny obsahující fosfor v nižším oxidačním čísle než III nejsou běžné. Organické sloučeniny P0 jsou zastoupeny adukty s karbeny, [P(NHC)]2, kde NHC je N-heterocyklický karben.[14] Sloučeniny PI (RP)n a PII (R2P)2 se dají získat redukcí odpovídajících organofosforitých chloridů:
Deriváty difosfenu, s obecným vzorcem R2P2, obsahují formálně dvojné vazby mezi atomy fosforu. Tyto fosforné sloučeniny jsou stabilní, pokud se na ně vážou organické substituenty dostatečně velké na to, aby bránily katenaci. Je také známo několik sloučenin, ve kterých mají atomy fosforu rozdílná oxidační čísla, příkladem může být klecovitá sloučenina P7(CH3)3.
Odkazy
Související články
Externí odkazy
- organofosforová chemie users.ox.ac.uk Archivováno 27. 4. 2006 na Wayback Machine; www.chem.wisc.edu
- Nástroj na předpovídání NMR chemických posunú u organických sloučenin fosforu Link
Reference
V tomto článku byl použit překlad textu z článku Organophosphorus compound na anglické Wikipedii.
- Merriam-Webster. Merriam-Webster's Unabridged Dictionary. [s.l.]: Merriam-Webster Dostupné v archivu pořízeném dne 2020-05-25. (anglicky)
- Lewis, Robert Alan. Lewisʼ Dictionary of Toxicology. [s.l.]: CRC Lewis, 1998. ISBN 978-1-56670-223-2. S. 763. (anglicky)
- Dillon, K. B.; Mathey, F.; Nixon, J. F. (1997) Phosphorus. The Carbon Copy; John Wiley & Sons, ISBN 0-471-97360-2
- Quin, L. D. (2000) A Guide to Organophosphorus Chemistry; John Wiley & Sons, ISBN 0-471-31824-8
- Racke, K.D. (1992). "Degradation of organophosphorus insecticides in environmental matrices", pp. 47–73 in: Chambers, J.E., Levi, P.E. (eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego, ISBN 0121673456.
- Svara, Jürgen; WEFERLING, NORBERT; HOFMANN, THOMAS. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2006. ISBN 978-3527306732. DOI 10.1002/14356007.a19_545.pub2. Kapitola Phosphorus Compounds, Organic. (anglicky)
- The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.p04548. (anglicky) DOI: 10.1351/goldbook.
- DOWNING, J.H.; SMITH, M.B. Phosphorus Ligands. Comprehensive Coordination Chemistry II. 2003, s. 253–296. ISBN 9780080437484. DOI 10.1016/B0-08-043748-6/01049-5. (anglicky)
- Arbuzova, S. N.; GUSAROVA, N. K.; TROFIMOV, B. A. Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes. Arkivoc. 2006, s. 12–36. DOI 10.3998/ark.5550190.0007.503. (anglicky)
- ZHANG, W.; SHI, M. Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones. Chemical Communications. 2006, s. 1218–1220. DOI 10.1039/b516467b. (anglicky)
- HINEY, Rachel M.; HIGHAM, Lee J.; MÜLLER-BUNZ, Helge; GILHEANY, Declan G. Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes. Angewandte Chemie International Edition. 2006, s. 7248–7251. DOI 10.1002/anie.200602143. PMID 17022105. (anglicky)
- STEWART, Beverly; HARRIMAN, Anthony; HIGHAM, Lee J. Predicting the Air Stability of Phosphines. Organometallics. 2011, s. 5338–5343. Dostupné online. DOI 10.1021/om200070a. (anglicky)
- DAVIES, Laura H.; STEWART, Beverly; HARRINGTON, Ross W.; CLEGG, William; HIGHAM, Lee J. Air-Stable, Highly Fluorescent Primary Phosphanes. Angewandte Chemie International Edition. 2012, s. 4921–4924. DOI 10.1002/anie.201108416. PMID 22431324. (anglicky)
- WANG, Yuzhong; XIE, Yaoming; WEI, Pingrong; KING, R. Bruce; SCHAEFER, Iii; SCHLEYER, Paul v. R.; ROBINSON, Gregory H. Carbene-Stabilized Diphosphorus. Journal of the American Chemical Society. 2008, s. 14970–1. DOI 10.1021/ja807828t. PMID 18937460. (anglicky)