Azobisizobutyronitril
Azobisisobutyronitril (zkráceně AIBN) je organická sloučenina se vzorcem [(CH3)2C(CN)]2N2, jde o bílý prášek rozpustný v alkoholech a dalších běžných organických rozpouštědlech, ovšem nerozpustný ve vodě. Používá se k tvorbě pěny u plastů a jako radikálový iniciátor.
| Azobisizobutyronitril | |
|---|---|
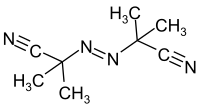
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | 2,2′-azobis(2-methylpropannitril) |
| Ostatní názvy | AIBN |
| Sumární vzorec | C8H12N4 |
| Vzhled | bílá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 78-67-1 |
| EC-no (EINECS/ELINCS/NLP) | 201-132-3 |
| PubChem | 6547 |
| SMILES | CC(C)(C#N)N=NC(C)(C)C#N |
| InChI | 1S/C8H12N4/c1-7(2,5-9)11-12-8(3,4)6-10/h1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 164,21 g/mol |
| Teplota tání | 101,5 °C (374,6 K)[1] |
| Teplota rozkladu | 107 °C (380 K)[1] |
| Hustota | 1,1 g/cm3[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v methanolu a ethanolu[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H242 H302 H332 H412[1] |
| P-věty | P210 P220 P234 P261 P264 P270 P271 P273 P280 P301+312 P304+312 P304+340 P312 P330 P372+378 P403+235 P411 P420 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Radikály vytvořené pomocí AIBN mají oproti organickým peroxidům několik výhod.[2] Nevytvářejí oxygenované vedlejší produkty ani nezpůsobují odbarvení. Jsou také vhodnější k použití v lepidlech, akrylátových barvách a v detergentech.
Mechanismus rozkladu
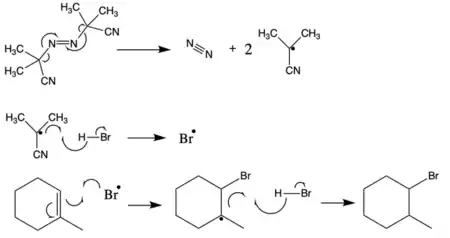
AIBN se za vyšších teplot rozkládá za odštěpení molekuly dusíku a tvorby dvou 2-kyanprop-2-ylových radikálů:
Protože azobisisobutyronitril snadno uvolňuje radikály, tak se často používá jako radikálový iniciátor. Tento rozklad nastává při teplotách nad 40 °C,[3] častěji se však provádí v rozmezí 66 °C až 72 °C.[4] ΔG‡ tohoto rozkladu činí 131 kJ/mol[4]. Uvolnění dusíku posunuje rovnováhu reakce ve prospěch produktů, protože se zvyšuje entropie. 2-kyan-2-propylový radikál je stabilizován −CN skupinami.
Reakce
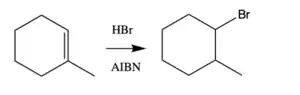
Radikály vzniklé rozkladem AIBN mohou spouštět radikálové polymerizace i jiné radikálové reakce, například směs styrenu a maleinanhydridu v toluenu po zahřátí za přítomnosti AIBN vytvoří kopolymer. Další využití může tato látka mít při protimarkovnikovských hydrohalogenacích alkenů.
Benzylové bromace
AIBN lze použít jako radikálový iniciátor Wohlových–Zieglerových bromací.
Reakce
2-Kyan-2-propylové radikály vytvořené rozkladem azobisizobutyronitrilu mohou odštěpit vodík z tributylcínu. Vznikají tím tributylcínové radikály, které lze využít v řadě různých reakcí, například při odštěpování bromu z alkenů.
Mechanismus
Reakce
Při hydrohalogenacích alkenů 2-kyan-2-propylové radikály vzniklé z AIBN odštěpí vodík z HBr a vytvoří tím radikál bromu. Tento radikál se následně naváže na alken. Hydrohalogenace za použití AIBN mají protimarkovnikovovskou regioselektivitu.
Mechanismus
Příprava
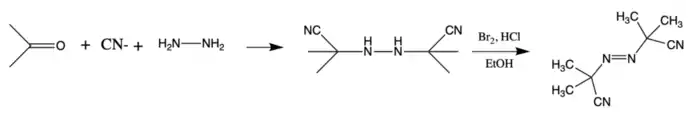
AIBN se připravuje reakcí acetonkyanhydrinu s hydrazinem a oxidací vzniklého produktu:[5]
- 2 (CH3)2C(CN)OH + N2H4 → [(CH3)2C(CN)]2N2H2 + 2 H2O
- [(CH3)2C(CN)]2N2H2 + Cl2 → [(CH3)2C(CN)]2N2 + 2 HCl
Podobné vlastnosti mají i obdobné azosloučeniny, jako je 1,1′-azobis(cyklohexankarbonitril) (ABCN). Jsou také známy azoiniciátory rozpustné ve vodě.[6][7]
Bezpečnost
AIBN je bezpečnější než benzoylperoxid, protože nebezpečí výbuchu je mnohem nižší; stále je ovšem považován za výbušninu, rozkládající se při teplotách nad 65 °C. Pyrolýza AIBN bez zachytávání 2-kyanpropylových radikálů vede k tvorbě vysoce toxického tetramethylsukcinonitrilu.
Reference
V tomto článku byl použit překlad textu z článku Azobisisobutyronitrile na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/6547
- AIBN initiator and other azo initiators. (n.d.). Retrieved from https://polymerchemistry.nouryon.com/products-applications/acrylic-polymer-initiators/aibn/
- 2,2′-Azobis(2-methylpropionitrile) 441090. (n.d.). Retrieved from https://www.sigmaaldrich.com/catalog/product/aldrich/441090?lang=en®ion=US
- Clayden, J., Greeves, N., & Warren, S. (2017). Organic chemistry. MTM
- Šablona:Ullmann
- Vazo Product Grades [online]. [cit. 2021-11-09]. Dostupné v archivu pořízeném dne 2009-03-26.
- http://www.wako-chem.co.jp/specialty/waterazo/index.htm
- Overberger, C. G., O'Shaughnessy, M. T., & Shalit, H. (1949). The Preparation of Some Aliphatic Azo Nitriles and their Decomposition in Solution. Journal of the American Chemical Society, 71(8), 2661-2666. doi:10.1021/ja01176a018



_Reaction.png.webp)
_Mechanism.png.webp)