Perkowova reakce
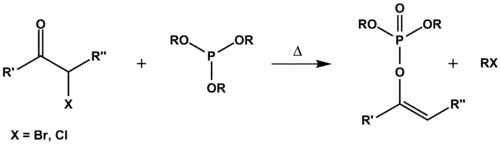
Perkowova reakce je organická reakce trialkylfosfitů s halogenketony za vzniku dialkylvinylfosfátů a halogenalkanů.
V Michaelisově–Arbuzovově reakci se ze stejných reaktantů tvoří beta-ketofosfonáty, které se využívají v Hornerově–Wadsworthově–Emmonsově reakci na přípravu alkenů. Perkowova reakce je tak považována za vedlejší reakci.
Mechanismus
Na začátku Perkowovy reakce je nukleofilní adice fosfitu na karbonylový uhlík za tvorby zwitteriontového meziproduktu. Následuje přesmyk tohoto meziproduktu na kation za odštěpení halogenidu. Kation se poté dealkyluje další nukleofilní reakcí, při které halogenidový anion reaguje s jednou z alkoxidových skupin fosfitu za tvorby enolfosfátu[1]

Využití
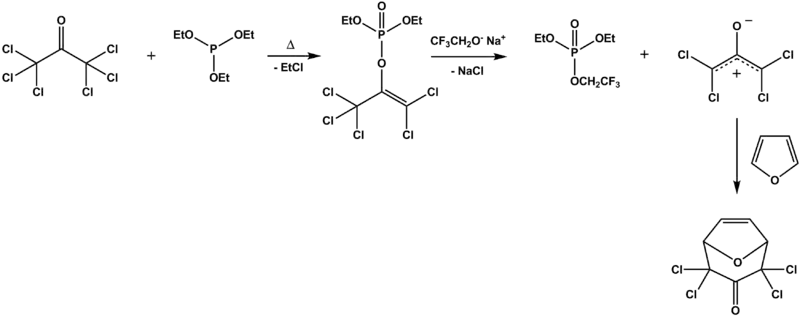
Perkowova reakce byla použita při syntéze repelentu skládajícího se z hexachloracetonu a triethylfosfitu, u kterého došlo za přítomnosti 2,2,2-trifluorethoxidu sodného, použitého jako zásada, k [4+3] cykloadici na furan.
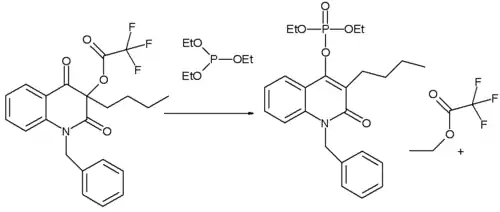
Perkowova reakce byla také součástí přípravy některých nových chinolinů. Když byl na reaktantu n-butylový substituent. tak vznikal obvyklý Perkowův produkt. Odcházející skupinou zde byl aryl s nízkou elektronovou hustotou (způsobenou třemi fluoridovými substituenty). Když však byla jako substituent použita fenylová skupina, tak enol reagoval převážně s acylovou skupinou a vznikal enolether. Odlišná reaktivita byla způsobena rozdílnými elektronovými hustotami na α-ketouhlíku.
Arylenolfosfáty získané Perkowovou reakcí lze použít jako fosforylační činidla, například k přeměně adenosinmonofosfátu (AMP) na adenosintrifosfát (ATP).
Reference
V tomto článku byl použit překlad textu z článku Perkow reaction na anglické Wikipedii.
- Organophosphorus chemistry. XVII. Kinetics and mechanism of the Perkow reaction Irving J. Borowitz , Steven Firstenberg , Grace B. Borowitz , David Schuessler J. Am. Chem. Soc.; 1972; 94 pp 1623–28; DOI:10.1021/ja00760a032
Externí odkazy
 Obrázky, zvuky či videa k tématu Perkowova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Perkowova reakce na Wikimedia Commons
- ^ Perkow, W. Chemische Berichte 1954, 87, 755–758
- ^ Hexachloroacetone as a Precursor for a Tetrachloro-substituted Oxyallyl Intermediate: [4+3] Cycloaddition to Cyclic 1,3-Dienes Baldur Föhlisch and Stefan Reiner Molecules 2004, 9, 1–10
- ^ New Modification of the Perkow Reaction: Halocarboxylate Anions as Leaving Groups in 3-Acyloxyquinoline-2,4(1H,3H)-dione Compounds Oldrich Paleta, Karel Pomeisl, Stanislav Kafka, Antonin Klasek, Vladislav Kubelka Beilstein Journal of Organic Chemistry 2005 Online Article
- ^ T. Moriguchi, K. Okada, K. Seio, and M. Sekine. "Synthesis and Stability of 1-Phenylethenyl Phosphate Derivatives and their Phosphoryl Transfer Activity", Letters in Organic Chemistry, 1 (2):140–144, 2004