Delokalizace elektronů
Jako delokalizované elektrony se v chemii označují elektrony v molekule, iontu nebo pevném kovu, které nelze přiřadit jedinému atomu či kovalentní vazbě.[1] Označení delokalizace může mít v různých oblastech mírně odlišné významy. V organické chemii se tak označuje rezonance v konjugovaných systémech a aromatických sloučeninách. Ve fyzice jde o volné elektrony, které zprostředkovávají elektrickou vodivost kovů. V kvantové chemii to jsou elektrony v molekulových orbitalech zasahujících přes několik sousedních atomů.
Rezonance
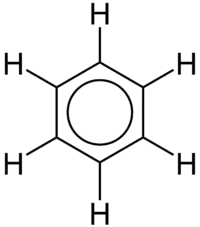
Na jednoduchém aromatickém kruhu benzenu dochází k delokalizaci šesti π elektronů nad rovinou benzenového jádra, což se často znázorňuje kruhem. Skutečnost, že všech 6 vazeb C-C má stejnou délku je jednou ze známek delokalizace elektronů; pokud by v molekule byly izolované dvojné vazby střídající se s jednoduchými, tak by se střídaly delší a kratší vazby. Ve teorii valenčních vazeb delokalizaci u benzenu představují jednotlivé rezonanční struktury.
Elektrická vodivost
Delokalizované elektrony se také vyskytují ve strukturách kovů v pevném skupenství. Struktura kovu se skládá z kationtů obklopených „oblakem“ delokalizovaných elektronů. Tyto elektrony se volně pohybují celou strukturou, což látce dodává vlastnosti jako je elektrická vodivost.
V diamantu jsou všechny čtyři valenční elektrony každého uhlíkového atomu 'lokalizovány' mezi atomy v kovalentních vazbách. Pohyb elektronů je omezen a diamant tak nevede elektrický proud. U grafitu se z každého uhlíku zapojují do vazeb jen tři ze čtyř elektronů; ty jsou propojené s dalšími třemi atomy uhlíku v rovině. Každý uhlík se jedním elektronem podílí na delokalizovaném systému, který je rovněž součástí vazebného systému. Delokalizované elektrony se mohou v dané rovině volně pohybovat a z tohoto důvodu je grafit elektricky vodivý v rovinách tvořených atomy uhlíku, ovšem nikoliv kolmo na ně.
Molekulové orbitaly
Použití standardních kvantově chemických metod vedlo k objevu delokalizovaných molekulových orbitalů a tak i rozprostřených po celých molekulách, které vykazují stejnou symetrii jako samotná molekula. Lokalizované orbitaly lze považovat za lineární kombinace delokalizovaných orbitalů.
Například pro molekulu methanu se ukázalo, že povaha vazeb ve čtyřech molekulových orbitalech odpovídá rovnoměrnému sdílení elektronu mezi všemi pěti atomy. Vyskytují se zde dvě úrovně orbitalů, vazebné molekulové orbitaly vytvořené 2s orbitaly uhlíkových atomů, a trojnásobně degenerované vazebné molekulové orbitaly od každého 2p orbitalu na uhlíku. Lokalizované sp3 orbitaly odpovídající jednotlivým vazbám podle teorie valenčních vazeb lze získat jako lineární kombinace čtyř molekulových orbitalů.
Odkazy
Související články
- Aromatický kruhový proud
- Elektrid
- Solvaovaný elektron
Reference
V tomto článku byl použit překlad textu z článku Delocalized electron na anglické Wikipedii.
- IUPAC Gold Book delocalization