Chlorbenzen
Chlorbenzen je aromatická organická sloučenina se sumárním vzorcem C6H5Cl. Tato bezbarvá hořlavá kapalina je běžně používaným rozpouštědlem a také meziproduktem pro výrobu dalších chemikálií.
| Chlorbenzen | |
|---|---|
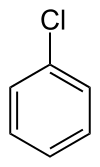
Strukturní vzorec chlorbenzenu | |

3D model molekuly chlorbenzenu | |
| Obecné | |
| Systematický název | chlorbenzen |
| Ostatní názvy | monochlorbenzen, benzenchlorid, fenylchlorid |
| Anglický název | Chlorobenzene |
| Německý název | Chlorbenzol |
| Sumární vzorec | C6H5Cl |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-90-7 |
| EC-no (EINECS/ELINCS/NLP) | 203-628-5 |
| Indexové číslo | 602-033-00-1 |
| PubChem | 7964 |
| SMILES | Clc1ccccc1 |
| InChI | 1/C6H5Cl/c7-6-4-2-1-3-5-6/h1-5H |
| Číslo RTECS | CZ0175000 |
| Vlastnosti | |
| Molární hmotnost | 112,56 g/mol |
| Teplota tání | −45 °C |
| Teplota varu | 131 °C |
| Hustota | 1,11 g/cm3 |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H332 H411 |
| R-věty | R10 R20 R51/53 |
| S-věty | (S2) S24/25 S61 |
| NFPA 704 |  3
3
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Použití
Chlorbenzen se dříve používal při výrobě některých pesticidů, zejména DDT reakcí s chloralem (trichloracetaldehydem), ale toto použití již není aktuální, vzhledem k výraznému omezení používání DDT. V určité době byl chlorbenzen hlavním prekurzorem při výrobě fenolu:[2]
- C6H5Cl + NaOH → C6H5OH + NaCl
V roce 2005 bylo hlavní oblastí použití chlorbenzenu jeho využití jako meziprodukt pro výrobu herbicidů, barviv a pryže. Chlorbenzen se používá také jako vysokovroucí rozpouštědlo pro mnoho průmyslových aplikací a v laboratoři. Specifickým použitím je nitrace chlorbenzenu na nitrochlorbenzen, který se pak převádí na fenolové, anisolové a anilinové deriváty.[3]
Syntéza
Chlorbenzen byl poprvé popsán v roce 1851, kdy byl připraven reakcí fenolu a chloridu fosforečného. Nyní se vyrábí chlorací benzenu za přítomnosti katalytického množství Lewisovy kyseliny, například chloridu železitého:
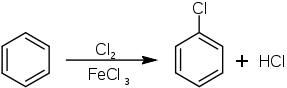
Katalyzátor zesiluje elektrofilní účinek chloru. Protože je chlor elektronegativní, C6H5Cl vykazuje sníženou citlivost na jiné elektrofily. Z tohoto důvodu vzniká při chloračním procesu pouze malé množství dichlor- a trichlorbenzenu.
Reference
V tomto článku byl použit překlad textu z článku Chlorobenzene na anglické Wikipedii.
- Chlorobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Manfred Weber, Markus Weber, Michael Kleine-Boymann, “Phenol” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005.
- Manfred Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006.


