Nukleofil
Nukleofil je chemická látka, která v chemické reakci poskytuje elektronový pár elektrofilu, čímž vzniká chemická vazba. Všechny molekuly nebo ionty s volnými páry elektronů mohou fungovat jako nukleofily. Protože nukleofil poskytuje elektrony, je z definice Lewisovou zásadou.
Nukleofilita (též nukleofilicita) označuje afinitu nukleofilu k atomovému jádru. Někdy se jí říká také nukleofilní síla, popisuje nukleofilní charakter látky a často se používá k porovnávání afinity atomů.
Neutrální nukleofilní reakce s rozpouštědly, například alkoholy nebo vodou, se označují jako solvolýza (např. v případě vody konkrétně hydrolýza). Nukleofily se účastní nukleofilní substituce, kde je nukleofil přitahován k plnému nebo částečnému kladnému náboji.
Historie
Termíny „nukleofil“ a „elektrofil“ zavedl Christopher Kelk Ingold v roce 1929,[1] nahradil jimi pojmy „kationoid“ a „anionoid“ dříve navržené Arthurem Lapworthem v roce 1925.[2]
Slovo „nukleofil“ je odvozeno od latinského nucleus („jádro“, v tomto případě atomové), a řeckého filein („mít rád“).
Vlastnosti
V řádku (periodě) periodické tabulky obecně platí, že čím zásaditější je iont (vyšší pKa konjugátové kyseliny), tím reaktivnější je jako nukleofil. V dané skupině je nejdůležitější vlastností při určení nukleofility polarizovatelnost: Čím snazší je zdeformovat elektronový obal okolo atomu či molekuly, tím snadněji reaguje; např. jodidový iont (I−) je nukleofilnější než iont fluoridový (F−).
Druhy nukleofilů
Mezi příklady nukleofilů patří anionty, například Cl−, nebo sloučeniny s volným párem elektronů, například amoniak NH3.
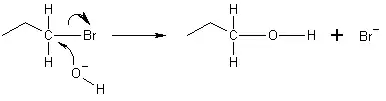
V příkladu uvedeném níže poskytuje kyslík z hydroxidového iontu elektronový pár k vazbě s uhlíkem na konci brompropanové molekuly. Vazba mezi uhlíkem a bromem pak podléhá heterolýze, atom bromu zachytí poskytnutý elektron a stane se bromidovým iontem (Br−). Probíhá SN2 reakce, což znamená, že hydroxidový iont působí na atom uhlíku na opačném konci oproti tomu, na kterém je bromidový iont. Proto reakce SN2 vedou k obrácení konfigurace elektrofilu. Je-li elektrofil chirální, obvykle si svou chiralitu udrží, byť je konfigurace produktu oproti původnímu elektrofilu převrácena.
Jako ambidentní nukleofil se označuje takový nukleofil, který může působit na dvou či více místech za vzniku dvou nebo více produktů. Například thiokyanatanový iont (SCN−) může působit jak atomem síry, tak dusíku. Proto reakce SN2 alkylhalogenidů s tímto iontem často dávají směs RSCN (alkylthiokyanátu) a RNCS (alkylisothiokyanátu). Podobně to platí i pro Kolbeho syntézu nitrilů.
Související články
Reference
V tomto článku byl použit překlad textu z článku Nucleophile na anglické Wikipedii.
- Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- Lapworth, A. Nature 1925, 115, 625