Fosfiny
Fosfiny jsou organické sloučeniny fosforu s obecným vzorcem PRnH3−n, kde R je organická skupina; jedná se o organické deriváty fosfanu (PH3).[1] Podle počtu organických substituentů n se dělí na primární (n = 1), sekundární (n = 2) a terciární fosfiny (n = 3). Všechny tyto skupiny zaujímají pyramidální struktury.[2]
Obecně jde o bezbarvé a lipofilní kapaliny či pevné látky.[3]
Rozdělení
Fosfiny se dělí na skupiny podle počtu organických substituentů.
Primární fosfiny
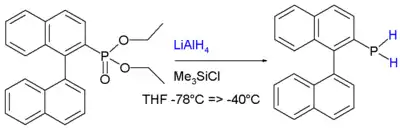
Primární fosfiny, RPH2, se obvykle připravují alkylacemi fosfanu. Jednoduché alkylové deriváty, jako například methylfosfin (CH3PH2), se získávají alkylacemi pomocí příslušných alkylů alkalických kovů, MPH2 (M = Li, Na nebo K). Dalším možným způsobem je reakce odpovídajícího chlorfosfinu s hydridem, například redukcí dichlorfenylfosfinu hydridem lithnohlinitým vzniká fenylfosfin (PhPH2).[4]
Primární (RPH2) a sekundární fosfiny (RRPH a R2PH) se za přítomnosti silných zásad ( například hydroxidu draselného v dimethylsulfoxidu vážou na alkeny, přičemž tyto reakce probíhají podle Markovnikovova pravidla. Podobné reakce probíhají i u alkynů.[5]
Zásada není potřeba u alkenů a alkynů s nedostatkem elektronů, jako jsou deriváty akrylonitrilu.
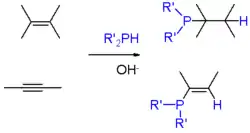 Obrázek 2: adice fosfanu a fosfinů na alkeny a alkyny
Obrázek 2: adice fosfanu a fosfinů na alkeny a alkyny
Sekundární fosfiny
Sekundární fosfiny, R2PH, se připravují podobně jako primární. Také je lze vytvořit redukčním štěpením triarylfosfinů pomocí alkalických kovů a následnou hydrolýzou vzniklého fosfidu; tímto způsobem se připravuje difenylfosfin (Ph2PH). Jiný postup spočívá v redukci difosfinových kyselin, R2P(O)OH, diisobutylaluminiumhydridem.
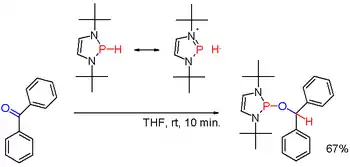
Sekundární fosfiny obvykle bývají protické, navázáním vhodných skupin, například u některých diazafosfolenů (viz obrázek 3), lze však polaritu vazby P-H obrátit a vzniklý fosfinhydrid může redukovat karbonylové skupiny, například u benzofenonu.[6]
Sekundární fosfiny se často vyskytují v cyklické podobě, jako tříčlenné (fosfirany a nenasycené (fosfireny), pětičlenné (fosfolany a nenasycené fosfoly a šestičlenné kruhy (fosfinany a fosforiny).
Terciární fosfiny
Terciární fosfiny, R3P, se zpravidla připravují alkylacemi chloridu fosforitého Grignardovými a organolithnými činidly:
- 3 RMgX + PCl3 → PR3 + 3 MgX2
Při přípravě trimethylfosfinu se používá trifenylfosfit namísto silně elektrofilního PCl3:[7]
3 CH3MgBr + P(OC6H5)3 → P(CH3)3 + 3 C6H5OMgBr
Nesymetrické terciární fosfiny, R2R'P, se získávají jinými postupy, převážně prostřednictvím organofosforových nukleofilů; například difenylfosfid lithný se lehce methyluje jodmethanem na methyldifenylfosfin:
- LiP(C6H5)2 + CH3I → CH3P(C6H5)2 + LiI
Fosfan lze použít jako prekurzor některých terciárních fosfinů, získávaných z něj hydrofosfinačními reakcemi s alkeny, například za přítomnosti zásad jako katalyzátorů se PH3 navazuje na Michaelovy akceptory, jako je akrylonitril:[8]
- PH3 + 3 CH2=CHZ → P(CH2CH2Z)3 (Z = NO2, CN, C(O)NH2)
Terciární fosfiny typu PRR′R″ jsou P-chirální.
Z průmyslového lediska je nejvýznamnějším fosfinem trifenylfosfin, kterého se ročně vyrobí tisíce tun. Získává se reakcí chlorobenzenu s chloridem fosforitým a sodíkem.[9]
Fosfiny s určitými speciálními vlastnostmi se většinou připravují jinými způsoby.[10]
Di- a tripfosfiny
Difosfiny a trifosfiny také mohou být primární, sekundární či terciární.
Struktura
Fosfiny mají, podobně jako fosfan, mají trigonálně pyramidové molekuly se symetrií přibližně typu C3v. Úhly vazeb C–P–C jsou přibližně 98,6°.[1] Velikost těchto úhlů odpovídá tomu, že fosfor vytváří vazby převážně prostřednictvím 3p orbitalů a jeho sp hybridizace je tak omezena. Volný elektronový pár trimethylfosfinu je tak převážně typu s, podobně jako u fosfanu, PH3.[11]
Pokud jsou organické substituenty terciárních fosfinů rozdílné, tak je příslušný fosfin chirální a konfiguračně stabilní (na rozdíl od NRR'R"). Komplexy chirálních fosfinů mohou katalyzovat enantioselektivní reakce.
Srovnání fosfinů a aminů
Fosfiny jsou fosforovými analogy aminů, atom fosforu v nich má oxidační číslo −3 (σ3λ3). Podobně jako aminy mají fosfiny trigonálně pyramidální molekuly, pouze úhly C-E-C (E = N, P), přinejmenším za nepřítomnosti sterických efektů, jsou menší. Vazebný úhel C-P-C činí 98,6° u trimethylfosfinu a 109,7° při nahrazení methylových skupin terc-butylovými. Míru sterických efektů u terciárních fosfinových ligandů lze vyjádřit Tolmanovým úhlem. Bariéra pyramidální inverze je u fosfinů mnohem větší než u aminů a fosfiny se třemi různými substituenty tak lze rozdělit na tepelně stálé optické izomery. Fosfiny bývají slabšími zásadami než odpovídající aminy, například fosfoniový kation má pKa −14 a amonný kation 9,21; u trimethylfosfonia činí pKa 8,65 a u trimethylamonia 9,76. Trifenylfosfin (pKa 2,73) je ovšem zásaditější než trifenylamin (pKa −5), protože volný elektronový pár na dusíku NPh3 je částečně delokalizovaný mezi fenylové kruhy. Přestože je u pyrrolu volný pár dusíku delokalizován, tak u atomu fosforu ve fosfolu není. Reaktivita fosfinů je podobná jako u aminů , s ohledem na nukleofilitu ipři tvorbě fosfoniových solí (PR4+X−). Tato vlastnost se využívá v Appelových reakcích k přeměně alkoholů na halogenalkany. Fosfiny se snadno oxidují na fosfinoxidy, zatímco obdobné oxidace aminů jsou obtížnější. Tato reaktivita je jednou z příčin vzácnosti fosfinů v přírodě.
Reakce
Tvorba komplexů
Terciární fosfiny se často používají jako ligandy v koordinační chemii. Fosfiny se navazují na kovy, které přitom slouží jako Lewisovy kyseliny, například chlorid stříbrný reaguje s trifenylfosfinem za vzniku 1:1 a 1:2 komplexů:
- PPh3 + AgCl → ClAgPPh3
- PPh3 + ClAgPPh3 → ClAg(PPh3)2
Produkty reakcí fosfinů s borany mají využití jako reaktanty, které jsou na vzduchu stálé, ale boranové chránicí skupiny lze odstranit působením aminů.[12][13]
Kvaternizace
Fosfiny se snadno alkylují, například brommethan přeměňuje trifenylfosfin na kvartérní sůl methyltrifenylfosfoniumbromid:
- PPh3 + CH3Br → [CH3PPh3+]Br−
Fosfiny fungují jako nukleofilní katalyzátory v některých organických syntézách, jako jsou Rauhutova–Currierova a Baylisova-Hillmanova reakce.
Protonace a deprotonace
Fosfiny mohou být, snadněji než fosfan, protonovány; reakce jsou vratné. Zatímco fosfiny jsou citlivé na přítomnost kyslíku, tak jejich protonované obdoby nejsou.
Primární a sekundární fosfiny lze deprotonovat silnými zásadami na fosfidy. Difenylfosfin reaguje s organolithními sloučeninami za tvorby difenylfosfidu lithného:
- HPPh2 + RLi → LiPPh2 + RH
Oxidace a sulfidace
Terciární fosfiny se oxidují na fosfinoxidy, R3PO. Reakce s kyslíkem je brzděna spinem, ovšem stále probíhá dostatečně rychle a vzorky terciárních fosfinů tak obsahují příměsi fosfinoxidů. U trialkylových fosfinů je oxidace rychlejší než u triarylových. Oxidaci je možné urychlit peroxidem vodíku. Primární a sekundární fosfiny se také oxidují, ovšem produkty podléhají tautomerizaci a další oxidaci.
Terciární fosfiny také mohou vytvářet fosfinsulfidy.
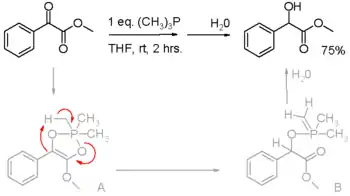
Redukční vlastnosti organofosfinů se také projevují ve Staudingerových reakcích, přeměňujících organické azidy na aminy, a v Micunobovových reakcích, kde se mění alkoholy na estery. V těchto procesech se trojmocný fosfor v molekule fosfinu oxiduje na pětimocný. Fosfiny mohou být také použity na redukce aktivovaných karbonylových sloučenin, například α-ketoesterů na α-hydroxyester (viz obrázek 2).[14]
V předpokládaném reakčním mechanismu se na začátku odštěpuje proton z methylové skupiny trimethylfosfinu (trifenylfosfin nereaguje).
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organophosphine na anglické Wikipedii.
- Annette Schier and Hubert Schmidbaur"P-Donor Ligands" in Encyclopedia of Inorganic Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/0470862106.ia177
- Paul C. J. Kamer; Piet W. N. M. van Leeuwen. Phosphorus(III)Ligands in Homogeneous Catalysis: Design and Synthesis. [s.l.]: [s.n.], 2012. ISBN 978-0-470-66627-2.
- G. M. Kosolapoff; L. Maier. Organic Phosphorus Compounds, Volume 1. New York: John Wiley, 1972.
- Rachel M. Hiney; Lee J. Higham; Helge Müller-Bunz; Declan G. Gilheany. Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes. Angewandte Chemie International Edition. 2006, s. 7248–7251. DOI 10.1002/anie.200602143. PMID 17022105.
- S. N. Arbuzova; N. K. Gusarova; B. A. Trofimov. Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes. Arkivoc. 2006, s. 12–36. DOI 10.3998/ark.5550190.0007.503.
- S. Burck; D. Gudat; M. Nieger; W.-W. Du Mont. P-Hydrogen-Substituted 1,3,2-Diazaphospholenes: Molecular Hydrides. Journal of the American Chemical Society. 2006, s. 3946–3955. DOI 10.1021/ja057827j. PMID 16551102.
- M. L. Leutkens; A. P. Sattelberger; H. H. Murray; J. D. Basil; J. P. Fackler. Trimethylphosphine. Inorganic Syntheses. 1990, s. 305–310. ISBN 9780470132593. DOI 10.1002/9780470132593.ch76.
- Boris A. Trofimov; Svetlana N. Arbuzova; Nina K. Gusarova. Phosphine in the Synthesis of Organophosphorus Compounds. Russian Chemical Reviews. 1999, s. 215–227. DOI 10.1070/RC1999v068n03ABEH000464. Bibcode 1999RuCRv..68..215T.
- Jürgen Svara; Norbert Weferling; Thomas Hofmann. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2006. ISBN 978-3527306732. DOI 10.1002/14356007.a19_545.pub2. Kapitola Phosphorus Compounds, Organic.
- J. H. Downing; M. B. Smith. Phosphorus Ligands. Comprehensive Coordination Chemistry II. 2003, s. 253–296. ISBN 9780080437484. DOI 10.1016/B0-08-043748-6/01049-5.
- E. Fluck, The Chemistry of Phosphine, Topics in Current Chemistry Vol. 35, 64 pp, 1973.
- Carole Alayrac; Sami Lakhdar; Ibrahim Abdellah; Annie-Claude Gaumont. Recent Advances in Synthesis of P-BH3 Compounds. Topics in Current Chemistry. 2014, s. 1–82. ISBN 978-3-319-15511-1. DOI 10.1007/128_2014_565.
- Jean Michel Brunel; Bruno Faure; Michel Maffei. Phosphane–Boranes: Synthesis, Characterization and Synthetic Applications. Coordination Chemistry Reviews. 1998, s. 665–698. DOI 10.1016/S0010-8545(98)00072-1.
- W. Zhang; M. Shi. Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones. Chemical Communications. 2006, s. 1218–1220. DOI 10.1039/b516467b. PMID 16518496.