Vodíková vazba
Vodíková vazba (často také vodíkový můstek) je nejsilnější z nevazebných interakcí. Může se uplatnit i v rámci dvou částí jedné molekuly. Je podstatně slabší než iontová nebo kovalentní vazba, ale silnější než většina ostatních mezimolekulárních sil.
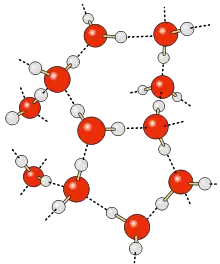
Vodíkovou vazbu tvoří na jedné straně skupina vodík + silně elektronegativní prvek (například kyslík nebo dusík) a na druhé straně atom s volným elektronovým párem (například opět kyslík, fluor nebo dusík).[1]
Vodíkové vazby se uplatňují například ve vodě, v různých organických sloučeninách, ale také v nukleových kyselinách.
Vznik vodíkové vazby
Protože má atom vodíku pouze jeden elektron, dojde při vytvoření vazby k elektronegativnímu prvku ke značnému odhalení jeho atomového jádra, tedy kladně nabitého protonu. Vzniklý parciální kladný náboj na atomu vodíku může poutat nevazebné elektronové páry okolních molekul (v případě intramolekulární vazby jde o elektronové páry stejné molekuly).
Vznik vodíkové vazby je možný pouze u molekul, kde je vodík vázán k některému z výrazně elektronegativních prvků, jako jsou fluor, kyslík a dusík. Jedině tyto tři prvky jsou schopné v dostatečné míře odčerpat elektronovou hustotu od atomu vodíku.
Vlastnosti vodíkové vazby
Vodíková vazba zahrnuje elektrostatické a kvantově-mechanické interakce. Z elektrostatických je to hlavně dipól-dipólová interakce a Londonovy disperzní síly.
Energie
Nejslabší vodíkové vazby mají vazební energii 1–2 kJ.mol−1, nejsilnější dosahuje energie 161,5 kJ.mol−1 u aniontu HF2−. Jsou tedy řádově 10× slabší než iontové nebo kovalentní vazby.
Délka vodíkové vazby závisí na energii vazby, teplotě a tlaku. Typická délka vodíkové vazby ve vodě je 1,97 Å.
Změny fyzikálních vlastností látek v důsledku vodíkové vazby
Vodíková vazba způsobuje zvětšení mezimolekulárních přitažlivých sil, což silně ovlivní fyzikálně-chemické vlastnosti systému (teplotu varu a tání, hustotu, viskozitu, (všechny se zvyšují) atd.). Díky vodíkové vazbě má voda H2O teplotu varu 100 °C, zatímco sulfan H2S, který vodíkové vazby nevytváří, vře při −60,75 °C.
Reference
- Vodíková vazba (vodíkový můstek) [online]. Vysoká škola chemicko-technologická [cit. 2012-09-07]. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu vodíková vazba na Wikimedia Commons
Obrázky, zvuky či videa k tématu vodíková vazba na Wikimedia Commons
