Sulfid fosforečný
Sulfid fosforečný (P2S5) je anorganická sloučenina. Je sirným analogem oxidu fosforečného.
Stejně jako P2O5 vytváří dimerní molekuly (P4S10). Jedná se o žlutou pevnou látku, často ovšem bývá znečištěn různými příměsemi, které jej zbarvují do nazelenavě žluté barvy.
| Sulfid fosforečný | |
|---|---|
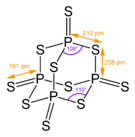
Strukturní vzorec | |
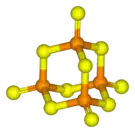
Model molekuly | |
| Obecné | |
| Systematický název | sulfid fosforečný |
| Anglický název | Phosphorus pentasulfide |
| Německý název | Phosphor(V)-sulfid |
| Sumární vzorec | P2S5 (monomer) P4S10 (dimer) |
| Vzhled | šedožlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 1314-80-3 |
| PubChem | 14817 |
| Číslo RTECS | TH4375000 |
| Vlastnosti | |
| Molární hmotnost | 444,555 g/mol (dimer) |
| Teplota tání | 275 ± 1 °C |
| Teplota varu | 513 °C |
| Hustota | 2,09 g/cm3 (17 °C) |
| Rozpustnost ve vodě | hydrolyzuje |
| Rozpustnost v nepolárních rozpouštědlech |
0,22 g/100 g (sirouhlík) benzen (ne) xylen (ne) anizol (ne) |
| Struktura | |
| Krystalová struktura | trojklonná |
| Hrana krystalové mřížky | a= 907 pm b= 907 pm c= 916 pm α= 100° β= 93°48´ γ= 108°30´ |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11, R20/22, R29, R50 |
| S-věty | (S2), S61 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura a příprava
Struktura
Tato sloučenina má tetraedrickou strukturu podobnou adamantanu, která je téměř totožná se strukturou oxidu fosforečného.[2]
Příprava
Sulfid fosforečný je připravován reakcí kapalného bílého fosforu se sírou při teplotách nad 300 °C:
P4 + 10 S → P4S10.
Poprvé jej takto připravil Berzelius v roce 1843.[3]
Alternativně může být připraven reakcí elementární síry nebo pyritu (FeS2) s fosfidem železa (Fe2P):
4 Fe2P + 18 S → P4S10 + 8 FeS
4 Fe2P + 18 FeS2 + teplo → P4S10 + 26 FeS.
Použití
Ročně je vyrobeno přibližně 150 000 tun sulfidu fosforečného.
Ten se nejčastěji převádí na ostatní deriváty, například dithiofosforečnany zinku, které se používají jako mazací aditiva.
Rovněž se používá na výrobu pesticidů, jako jsou například parathion a malathion.[4] Je také složkou některých amorfních pevných elektrolytů pro některé typy lithiové články.
Také může být použit pro výrobu VX.
Reaktivita
Z důvodu hydrolýzy vzdušnou vlhkostí sulfid fosforečný vyvíjí H2S, kromě toho také vzniká kyselina fosforečná:
P4S10 + 16 H2O → 4 H3PO4 + 10 H2S.
V organické chemii se používá jako thionační činidlo.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Phosphorus pentasulfide na anglické Wikipedii.
- Phosphorus pentasulfide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- D. E. C. Corbridge. Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology, 5th Edition. Amsterdam: Elsevier, 1995. ISBN 0-444-89307-5. (anglicky)
- DEMSELBEN. Ueber die Verbindungen des Phosphors mit Schwefel. Annalen der Chemie und Pharmacie. 1843, s. 251. DOI 10.1002/jlac.18430460303. (anglicky)
- Gerhard Bettermann, Werner Krause, Gerhard Riess, Thomas Hofmann “Phosphorus Compounds, Inorganic” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a19_527
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.:
Externí odkazy
 Obrázky, zvuky či videa k tématu Sulfid fosforečný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfid fosforečný na Wikimedia Commons


