Aminoxidy
Aminoxidy, též nazývané amin-N-oxidy nebo N-oxidy, jsou chemické sloučeniny s molekulami obsahujícími funkční skupiny R3N+−O−; mezi atomy dusíku a kyslíku je koordinačně kovalentní vazba. R mohou být atomy vodíku nebo uhlovodíkové skupiny.
Jako aminoxidy by se měly nazývat pouze oxidy terciárních aminů, i když se toto označení někdy používá i pro odpovídající deriváty primárních a sekundárních aminů.
Příklady aminoxidu mohou být pyridin-N-oxid, což je ve vodě rozpustná krystalická látka s teplotou tání 62–67 °C, a N-methylmorfolin-N-oxid, který se používá jako oxidační činidlo.
Příprava a výroba
Aminoxidy se získávají N-oxidací terciárních aminů či pyridinů pomocí peroxidu vodíku (H2O2) nebo peroxokyseliny, jako jsou například kyselina peroxosírová a kyselina meta-chlorperoxybenzoová.[1]
Vlastnosti
Aminoxidy jsou velmi polární látky, svojí úrovní polarity se podobají kvartérním amoniovým sloučeninám. Aminoxidy s menšími molekulami jsou silně hydrofilní, velmi dobře rozpustné ve vodě a špatně rozpustné ve většině organických rozpouštědel.
Aminoxidy jsou slabé zásady, jejichž pKb se pohybuje kolem 4,5. V prostředí s nižším pH, než je jejich pKb, tvoří kationtové hydroxylaminy R3N+−OH.
Reakce
U aminoxidů může dojít k řadě různých reakcí, kterými jsou:[2]
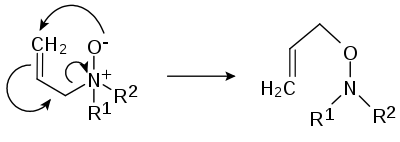
- Pyrolytická eliminace – Z aminoxidů se při zahřátí na 150 až 200 °C odštěpuje hydroxylamin, čímž dojde ke vzniku alkenu.
- Redukce na aminy – Aminoxidy lze přeměnit na odpovídající aminy pomocí redukčních činidel, jako jsou hydrid lithno-hlinitý a tetrahydridoboritan sodný; případně katalytickou redukcí zinkem nebo železem s kyselinou octovou. Pyridin-N-oxidy lze deoxygenovat reakcí s oxychloridem fosforečným.
- Regenerace oxidačních činidel – Redukcí N-oxidů lze regenerovat některá oxidační činidla, například oxid osmičelý pomocí N-methylmorfolin oxidu.
- O-alkylace - Pyridin-N-oxidy reagují s alkylhalogenidy za vzniku O-alkylovaných produktů.
- Deriváty bis-terpyridinu adsorbované na stříbru reagují s kyslíkem za tvorby bis-terpyridin-N-oxidů.[3]
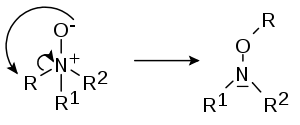
- Při Meisenheimerově přesmyku (pojmenovaném po Jakobu Meisenheimerovi) se některé N—oxidy R1R2R3N+O− přesmykují na hydroxylaminy R2R3N−O−R1[4][5]
- Může dojít k 1,2-přesmyku:
- nebo k 2,3-přesmyku:
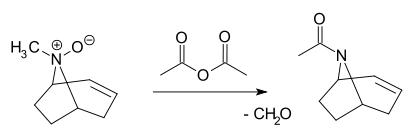
- V Polonovského reakci se terciární N-oxid štěpí pomocí anhydridu kyseliny octové na acetamid a aldehyd:[6][7][8]
Použití
Aminoxidy se používají v organické syntéze jako chránicí skupiny pro aminy a také jako meziprodukty některých reakcí.
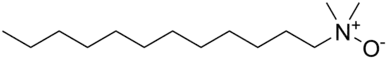
Aminoxidy s dlouhými alkylovými řetězci fungují jako amfolytické tenzidy, čehož se využívá v šamponech a čisticích prostředcích.[9] Nejčastěji se používají alkyldimethylové aminoxidy s řetězci s 10 až 16 atomy uhlíku.[10] Více než 95 % vyrobených aminoxidů je součástí čisticích prostředků pro domácnosti,[11] kde fungují jako stabilizátory, zahušťovadla, změkčovadla a emulgátory; aktivní koncentrace se pohybují v rozmezí 0,1 % až 10 %.[9] Zbylých necelých 5 % se využívá v kosmetice, průmyslu[12] a v některých patentovaných metodách - například ve fotografii.[9]
Bezpečnost
U aminoxidů (AO) nebyla prokázána karcinogenita, dráždivost ani reprodukční toxicita. Tyto látky se snadno metabolizují a při pozření jsou rychle vyloučeny. Chronické vystavení králíků aminoxidům mělo za následek úbytek tělesné hmotnosti, průjem a neprůhlednost rohovky (dávky se pohybovaly v rozmezí 87–150 mg/kg za den). Při jiných testech bylo zjištěno, že po osmihodinovém působení na lidskou kůži do těla projde méně než 1 % aminoxidů. Oční dráždivost je u aminoxidů a jiných tenzidů mírná a bez trvalých následků.[9]
V životním prostředí
Při měření rozpustnosti aminoxidů s průměrnou délkou uhlíkových řetězců 12,6 byly naměřeny hodnoty kolem 410 g/l. Předpokládaný bioakumulační potenciál u vodních organismů je nízký.[9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Amine oxide na anglické Wikipedii.
- Recent trends in the chemistry of pyridine N-oxides Shaker Youssif Arkivoc 2001 Link[nedostupný zdroj]
- Albini, Angelo. Synthetic utility of amine N-oxides. Synthesis. 1993, s. 263–77. (anglicky)
- WALDMANN, T. Oxidation of an Organic Adlayer: A Bird's Eye View. Journal of the American Chemical Society. 2012, roč. 134, s. 8817. PMID 22571820. (anglicky)
- J. Meisenheimer, Ber. 52. 1667 (1919)
- March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure Michael B. Smith, Jerry March Wiley-Interscience, 5th edition, 2001, ISBN 0-471-58589-0
- GRIERSON, D. The Polonovski Reaction. Organic Reactions. 1990, roč. 39, s. 85. (anglicky)
- M. Polonovski, M. Polonovski, Bull. Soc. Chim. France 41, 1190 (1927).
- Strategic Applications of Named Reactions in Organic Synthesis (Paperback) by Laszlo Kürti, Barbara Czako ISBN 0-12-429785-4.
- ORGANISATION FOR ECONOMIC CO-OPERATION AND DEVELOPMENT (OECD). Amine Oxides [online]. 2006. Dostupné v archivu pořízeném dne 22 February 2014. (anglicky)
- SANDERSON, H; C Tibazarwa; W Greggs; DJ Versteeg. High Production Volume Chemical Amine Oxides [C8–C20]. Risk Analysis. 2009, roč. 29, čís. 6, s. 857–867. (anglicky)
- Modler, RF; Inoguchi Y. CEH Marketing Research Report: Surfactants, Household Detergents, and their Raw Materials [online]. Menlo Park, CA: SRI Consulting, 2004. Dostupné online. (anglicky)
- SANDERSON, H; Counts JL; Stanton K; Sedlak R. Exposure and Prioritization—Human Screening Data and Methods for High Production Volume Chemicals in Consumer Products: Amine Oxides a Case Study.. Risk Analysis. 2006, roč. 26, čís. 6, s. 1637–1657. (anglicky)