Hornerova–Wadsworthova–Emmonsova reakce
Hornerova–Wadsworthova–Emmonsova reakce je reakce v organické chemii, při které reagují fosfonátové karboanionty s aldehydy nebo ketony, přičemž vznikají (stereoselektivně) hlavně E-alkeny.
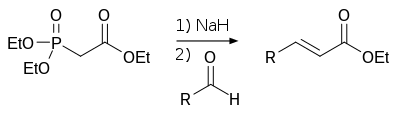
V roce 1958 popsal německý chemik Leopold Horner pozměněnou Wittigovu reakci, při níž využíval karboanionty stabilizované fosfonátovými skupinami.[1][2] Následně William S. Wadsworth a William D. Emmons sestavili definici tohoto typu reakce.[3][4]
V porovnání s ylidy fosfonia, použitými při Wittigově reakci, jsou karboanionty stabilizované fosfonátovými skupinami silnějšími nukleofily, ovšem slabšími zásadami. Tyto karboanionty mohou být alkylovány. Na rozdíl od reakce s ylidy fosfonia lze dialkylfosfoniovou sůl vznikající jako vedlejší produkt snadněji odstranit kapalinovou extrakcí s použitím vody.
Bylo vydáno několik prací zabývajících se touto reakcí.[5][6][7][8][9][10]
Mechanismus
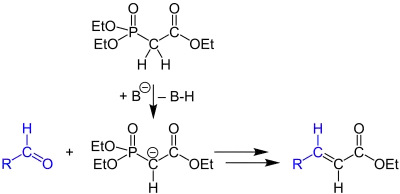
Hornerova–Wadsworthova–Emmonsova reakce začíná deprotonací fosfonátu za vzniku fosfonátového karboaniontu 1. Nukleofilní adicí fosfonátu na aldehyd 2 nebo keton vznikne meziprodukt 3a nebo 3b; tento krok určuje rychlost reakce.[11] Pokud je skupinou R2 vodíkový atom, tak se meziprodukty 3a a 4a, případně 3b a 4b mohou přeměňovat jeden v druhý.[12] Nakonec eliminací 4a a 4b vznikne E-alken 5 a Z-alken 6. Vedlejším produktem je dialkylfosfát.

Poměr množství izomerních alkenů 5 a 6 záleží na stereochemii počáteční adice karboaniontu a na schopnosti meziproduktů vytvořit chemickou rovnováhu.
K poslednímu kroku, kterým je eliminační reakce, je nutné, aby se na pozici alfa nacházela skupina, která odtahuje elektrony. Pokud by nebyla přítomna, tak by konečnými produkty byly α-hydroxyfosfonáty 3a a 3b,[13] které ovšem lze na alkeny reakcí s diisopropylkarbodiimidem.[14]
Stereoselektivita
Při Hornerově–Wadsworthově–Emmonsova reakci vznikají přednostně (ve větším množství) E-alkeny. Obecně platí, že čím lepší je rovnováha mezi meziprodukty, tím výraznější je E-alken ů mezi produkty.
Disubstituované alkeny
Byla provedena systematická studie reakcí methyl-2-(dimethylfosfono)acetátu s různými aldehydy.[15] Ukázalo se, že by bylo možné pozměnit stereochemii produktů, aniž by se změnila struktura fosfonátu. E-stereoselektivita je výraznější za následujících podmínek:
- Sterické efekty vyvolávané aldehydem jsou výraznější,
- reakční teplota je vyšší (v tomto případě 23 °C oproti −78 °C) nebo
- jako rozpouštědlo se místo tetrahydrofuranu (THF) použije dimethoxyethan (DHE).
E-stereoselektivita je také ovlivňována druhem použité soli, klesá v řadě Li > Na > K.
Trisubstituované alkeny
Sterické jevy vytvářené fosfonátem a skupinami odtahujícími elektrony mají velký význam při reakcích α-rozvětvených fosfonátů s alifatickými aldehydy.[16]
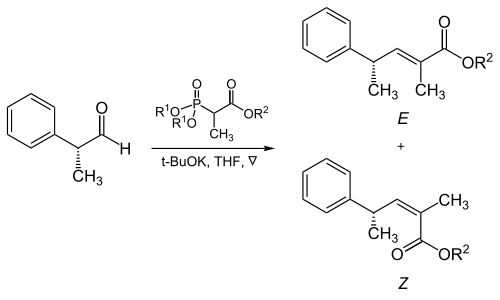
| R1 | R2 | Poměr množství alkenů ( E : Z ) |
|---|---|---|
| Methyl | Methyl | 5 : 95 |
| Methyl | Ethyl | 10 : 90 |
| Ethyl | Ethyl | 40 : 60 |
| Isopropyl | Ethyl | 90 : 10 |
| Isopropyl | Isopropyl | 95 : 5 |
Aromatické aldehydy poskytují téíměř výhradně E-produkty. Pokud je třeba z těchto aldehydů získat Z-alkeny, je nutné provést Stillovu–Gennariovu modifikaci (popsanou níže).
Obměny
Substráty citlivé na zásady
Jelikož mnoho substrátů s hydridem sodným, tak bylo vyvinuto několik variant Hornerovy–Wadsworthovy–Emmonsovy reakce probíhající za mírnějších podmínek; například za použití chloridu lithného a 1,8-diazabicyklo(5.4.0)undec-7-enu (DBU).[17] Další možností je použití lithných či hořečnatých halogenidů s triethylaminem;.[18] lze přitom použít i další zásady, jako jsou [19][20][21]
Stillova–Gennariova modifikace
W. Clark Still a C. Gennari objevili variantu Hornerovy–Wadsworthovy–Emmonsovy reakce, při které vznikají Z-alkeny s vysokou stereoselektivitou.[22] Za použití fosfonátů se skupinami odtahujícími elektrony (trifluoroethyl[23]) a značně disociačních podmínek (hexamethyldisilazid draselný a 18-crown-6 v tetrahydrofuranu) vznikají téměř výhradně Z-alkeny.
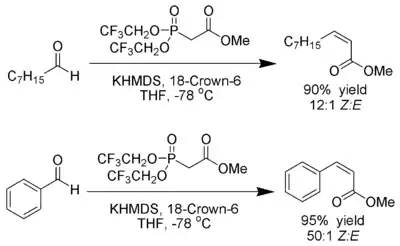
Bylo zjištěno, že použití fosfonátů s nízkou elektronovou hustotou urychluje eliminaci oxafosfetanových meziproduktů.[24]
Reference
V tomto článku byl použit překlad textu z článku Horner–Wadsworth–Emmons reaction na anglické Wikipedii.
- Leopold Horner; Hoffmann, H. M. R.; Wippel, H. G. Ber. 1958, 91, 61–63.
- Horner, L.; Hoffmann, H. M. R.; Wippel, H. G.; Klahre, G. Ber. 1959, 92, 2499–2505.
- Wadsworth, W. S., Jr.; Emmons, W. D. Journal of the American Chemical Society 1961, 83, 1733. (DOI:10.1021/ja01468a042)
- Wadsworth, W. S., Jr.; Emmons, W. D. Organic Syntheses, Coll. Vol. 5, p.547 (1973); Vol. 45, p.44 (1965). (Article)
- Wadsworth, W. S., Jr. Org. React. 1977, 25, 73–253. (Review)
- Boutagy, J.; Thomas, R. Chemical Reviews 1974, 74, 87–99. (Review, DOI:10.1021/cr60287a005)
- Kelly, S. E. Compr. Org. Synth. 1991, 1, 729–817. (Review)
- B. E. Maryanoff; Reitz, A. B. Chem. Rev. 1989, 89, 863–927. (Review, DOI:10.1021/cr00094a007)
- Bisceglia, J. A., Orelli, L. R. Current Organic Chemistry 2012, 16, 2206–2230 (Review)
- Bisceglia, J. A., Orelli, L. R. Current Organic Chemistry 2015, 19, 744–775 (Review)
- Larsen, R. O.; Aksnes, G. Phosphorus Sulfur 1983, 15, 218–219.
- Lefèbvre, G.; Seyden-Penne, J. ChemComm 1970, 1308–09.
- Corey, E. J.; Kwiatkowski, G. T. Journal of the American Chemical Society 1966, 88, 5654–56. (DOI:10.1021/ja00975a057)
- Reichwein, J. F.; Pagenkopf, B. L. Journal of the American Chemical Society 2003, 125, 1821–24. (DOI:10.1021/ja027658s)
- Thompson, S. K.; Heathcock, C. H. The Journal of Organic Chemistry 1990, 55, 3386–88. (DOI:10.1021/jo00297a076)
- Nagaoka, H.; Kishi, Y. Tetrahedron 1981, 37, 3873–3888.
- Blanchette, M. A.; Choy, W.; Davis, J. T.; Essenfeld, A. P.; Masamune, S.; Roush, W. R.; Sakai, T. Tetrahedron Letters 1984, 25, 2183–2186.
- Rathke, M. W.; Nowak, M. J. Org. Chem. 1985, 50, 2624–2626. (DOI:10.1021/jo00215a004)
- Paterson, I.; Yeung, K.-S.; Smaill, J. B. Synlett 1993, 774.
- Simoni, D.; Rossi, M.; Rondanin, R.; Mazzali, A.; Baruchello, R.; Malagutti, C.; Roberti, M.; Invidiata, F. P. Organic Letters 2000, 2, 3765–3768.
- Blasdel, L. K.; Myers, A. G. Org. Letters 2005, 7, 4281–4283.
- Still, W. C.; Gennari, C. Tetrahedron Letters 1983, 24, 4405–4408.
- Patois, C.; Savignac, P.; About-Jaudet, E.; Collignon, N. Organic Syntheses, Coll. Vol. 9, p.88 (1998); Vol. 73, p.152 (1996). ( Archivováno 30. 9. 2007 na Wayback Machine)
- Ando, K. J. Org. Chem. 1997, 62, 1934–1939. (DOI:10.1021/jo970057c)
Externí odkazy
 Obrázky, zvuky či videa k tématu Hornerova–Wadsworthova–Emmonsova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hornerova–Wadsworthova–Emmonsova reakce na Wikimedia Commons