Fosfonáty
Fosfonáty a fosfonové kyseliny jsou v organické chemii sloučeniny, v jejichž molekulách se nachází skupiny C−PO(OH)2 nebo C−PO(OR)2 (R může být alkyl nebo aryl). Fosfonové kyseliny se obvykle vyrábějí jako soli a jedná se o netěkavé kapaliny málo rozpustné v organických rozpouštědlech, ovšem rozpustné ve vodě a alkoholech. K fosfonátům patří mnoho významných látek, jako je herbicid glyfosát. Bisfosfonáty, molekuly se dvěma fosfonátovými skupinami, jsou součástí některých léčiv proti osteoporóze.[1] V lékařské chemii se fosfonátové skupiny používají jako náhrady fosfátových skupin v léčivech; příkladem je tenofovir, používaný při léčbě HIV.
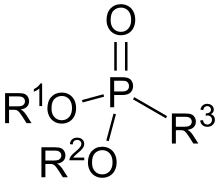
Vlastnosti
Molekuly fosfonátů mají tvar tetradedru s atomem fosforu ve středu. Strukturou se podobají kyselině fosfonové, z níž se také často připravují.[2]
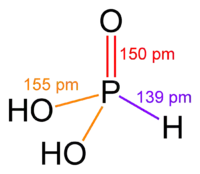
Fosfonátové soli vznikají z fosfonových kyselin, které jsou dvojsytné:
- RPO(OH)2 + NaOH → H2O + RPO(OH)(ONa) (monosodný fosfonát)
- RPO(OH)(ONa) + NaOH → H2O + RPO(ONa)2 (disodný fosfonát)
Fosfonátové estery lze připravit reakcí fosfonové kyseliny s příslušným alkoholem.
Příprava
Existuje několik způsobů přípravy fosfonových kyselin a jejich solí.
Z kyseliny fosfonové
Nejběžnější metody přípravy fosfonátů vycházejí z kyseliny fosfonové (H3PO3), která je stabilnějším tautomerem kyseliny fosforité, přičemž se využívá reaktivita vazby P-H.[1][2]
Fosfonové kyseliny lze alkylovat Mannichovou reakcí za vzniku aminoalkylovaných fosfonátů, které se dají použít jako komplexační činidla; příkladem může být průmyslová výroba kyseliny nitrilotris(methylen)fosfonové:
- NH3 + 3 H3PO3 + 3 CH2O → (CH2PO3H2)3 + 3 H2O
Další možností je alkylace deriváty kyseliny akrylové za tvorby karboxylovaných fosfonových kyselin; tato reakce je variantou Michaelovy adice:
- CH2=CHCO2R + 3 H3PO3 → (HO)2P(O)CH2CH2CO2R
Při Hiraově reakci reagují dialkylfosfity (které lze považovat za diestery kyseliny fosfonové, s obecným vzorcem (O=PH(OR)2)) s arylhalogenidy za přítomnosti palladiového katalyzátoru, přičemž vznikají fosfonáty.
Michaelisova–Arbuzovova reakce
Estery fosfonových kyselin se připravují Michaelisovou–Arbuzovovou reakcí. Příkladem je přeměna trimethylfosfitu na dimethylmethylfosfonát za katalýzy jodmethanem:
- P(OMe)3 → MePO(OMe)2
Tyto estery je možné hydrolyzovat na kyseliny
- CH3PO(OMe)2 + H2O → CH3PO(OH)2 + 2 CH3OH
Při Michaelisově–Beckerově reakci je nejprve deprotonován hydrogenfosfonátový diester a vzniklý anion se poté alkyluje.
Z chloridu fosforitého
Vinylfosfonové kyseliny se dají připravit reakcí chloridu fosforitého s acetaldehydem:
- PCl3 + CH3CHO → CH3CH(O−)PCl +
3
Takto vzniklý adukt reaguje s kyselinou octovou:
- CH3CH(O−)PCl +
3 + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
Připravený chlorid se nakonec dechloruje za vzniku konečného produktu:
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl
V Kinnearově–Perrenově reakci se tvoří alkyldifosfonylové estery a chloridy za přítomnosti chloridu hlinitého. Meziprodukty jsou alkyltrichlorfosfoniové soli.[1]
- PCl3 + RCl + AlCl3 → RPCl +
3 + AlCl -
4
Produkt této reakce (RPCl +
3 ) je možné hydrolyzovat na alkylfosfoniumdichlorid RP(=O)Cl2.
Reakce
Hydrolýza
Fosfonátové estery podléhají hydrolýze, a to v kyselém i zásaditém prostředí.
- O=PC(OR)2 + 2 H2O → O=PC(OH)2 + 2 ROH
Rozštěpení vazby P-C je obtížnější, ale v agresivnějších podmínkách jej lze provést.
Hornerova–Wadsworthova–Emmonsova reakce
Při Hornerově–Wadsworthově–Emmonsově reakci se dialkylfosfonáty deprotonují za vzniku stabilních karboaniontů, které reagují s aldehydy na E-alkeny za současného odštěpení dialkylfosfátu.[3]
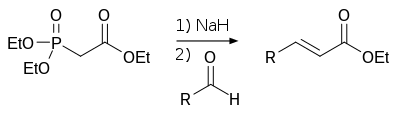 Hornerova–Wadsworthova–Emmonsova reakce
Hornerova–Wadsworthova–Emmonsova reakce
Rozdělení podle struktury
Bisfosfonáty
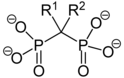
Sloučeniny, které mají na stejný atom uhlíku navázány dvě fosfonátové skupiny, se nazývají bisfosfonáty. Poprvé je připravili v roce 1897 Adolf von Baeyer a Fritz Hofmann; v současnosti se bisfosfonátové skupiny využívají jako součásti molekul některých léčiv na osteoporózu, jako je kyselina etidronová, jež se připravuje reakcí kyseliny fosforečné s acetanhydridem:[1]
- 2 H3PO3 + (CH3CO)2O → CH3C(OH)(PO3H2)2 + CH3CO2H
Thiofosfonáty
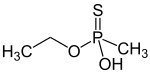 kyselina O-ethyl-methylfosfonothiová (thionová forma)
kyselina O-ethyl-methylfosfonothiová (thionová forma)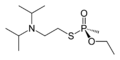 VX (thiolová forma)
VX (thiolová forma)
Thiofosfonátová skupina je od fosfonátové formálně odvozena náhradou kyslíkového atomu atomem síry. Je častou složkou pesticidů a nervových jedů. Substituované thiofosfonáty mohou mít dva strukturní izomery - pokud je na fosfor dvojnou vazbou napojen atom síry, jedná se o thionovou formu, pokud je takto napojen kyslík, jde o formu thiolovou; podobná vlastnost existuje například u thiokarboxylových kyselin a organothiofosfátů.
Fosfonamidáty
Fosfonamidátovou skupinu lze od fosfonátové odvodit nahrazením kyslíkového atomu dusíkovým. Jde o poměrně málo používanou funkční skupinu, která se nachází například v molekule tabunu.
Výskyt
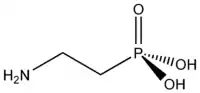
V roce 1959 byla u některých rostlin a živočichů objevena kyselina 2-aminoethylfosfonová, která je přírodním fosfonátem, vyskytujícím se v buněčných membránách. Fosfonáty se vyskytují například v bakteriích, houbách, měkkýších a hmyzu. V půdě byly přírodní fosfonáty poprvé nalezeny v roce 1980. Jejich biologické funkce dosud nejsou dobře známy. Bisfosfonáty a polyfosfonáty se v přírodě nevyskytují.
Je známo několik přírodních fosfonátů s antibiotickými vlastnostmi,[4] například fosfomycin, používaný při léčbě infekcí močových cest, nebo fosmidomycin (inhibitor isoprenylsyntázy), SF-2312 (inhibitor enolázy)[5] a látky, jejichž účinek není přesně znám, jako například alahopcin. Tato antibiotika jsou účinná proti velkému počtu bakterií, protože ty často mají přenašeče glycerol-3-fosfátu a glukóza-6-fosfátu, jejich funkci lze narušit fosfonáty. Kmeny bakterií odolné vůči fosfomycinu mívají mutace, které tyto přenašeče deaktivují.
Použití
Chelatační činidla
Gerold Schwarzenbach v roce 1949 zjistil, že fosfonáty jsou účinná chelatační činidla. Schopnost fosfonátu vázat kovy je možné vylepšit připojení aminové skupiny (−NH2) na molekulu fosfonátu za vzniku −NH2−C−PO(OH)2; takovými látkami jsou například NTMP, EDTMP a DTPMP, které jsou strukturními analogy aminopolykarboxylátů, jako je kyselina ethylendiamintetraoctová. Stabilita komplexů se zvyšuje s počtem fosfonátových skupin.
Fosfonáty na sebe mohou navázat dvojmocné a trojmocné ionty , čehož lze využít k odstraňování tvrdosti vody; tímto způsobem lze i vylepšit katalytické vlastnosti iontů. Z těchto důvodů se fosfonáty využívají k zamezení tvorby vodního kamene v průmyslu nebo v přístrojích provádějících reverzní osmózu. Tam, kde se voda používá jako chladivo, také zabraňují korozi. Při výrobě papíru stabilizují peroxidy (používané k bělení) tím, že zachytávají ionty kovů, které by mohly způsobovat rozklad peroxidů. Jako chelatační činidla a k omezení tvorby vodního kamene se používají i v tenzidech.
Lékařství
V lékařství se monofosfonáty a bisfosfonáty používají jako inhibitory enzymů, které katalyzují reakce fosfátů a bisfosfátů, jako jsou například enzymy podílející se na syntéze cholesterolu.[6]
Fosfonátové analogy nukleotidů, například tenofovir, cidofovir a adefovir se používají jako antivirotika mimo jiné při léčbě HIV nebo hepatitidy B.
Toxicita
Fosfonáty nejsou příliš toxické pro vodní organismy. Hodnoty LC50 při 48hodinovém vystavení těmto látkám se pohybují mezi 0,1 a 1,1 mmol/l.
Příklady
- Tenofovir alafenamid - proléčivo tenofoviru, používaného při léčbě HIV
- Kyselina aminomethylfosfonová - produkt rozkladu glyfosátu
- Kyselina vinylfosfonová - surovina na výrobu polymerů
- Dimethylmethylfosfonát - jeden z nejjednodušších fosfonátových diesterů
- Kyselina etidronová (1-hydroxyethyliden-1,1-difosfonová) - používá se jako tenzid při úpravě vody, výrobě kosmetických přípravků a léčiv
- Kyselina ethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina tetramethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina hexamethylendiamintetra(methylenfosfonová), chelatační činidlo
- Kyselina diethylentriaminpenta(methylenfosfonová), chelatační činidlo
- Glyfosát, herbicid
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Fosfonáty na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fosfonáty na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Phosphonate na anglické Wikipedii.
- Svara, J.; Weferling, N.; Hofmann, T. "Phosphorus Compounds, Organic," in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2008. DOI:10.1002/14356007.a19_545.pub2.
- Modern Phosphonate Chemistry by Philippe Savignac and Bogdan Iorga, CRC Press, Boca Raton, FL, 2003. ISBN 0-8493-1099-7
- John Boutagy; Richard Thomas. Olefin synthesis with organic phosphonate carbanions. Chemical Reviews. 1974, s. 87–99.
- K. S. Ju; J. R. Doroghazi; W. W. Metcalf. Genomics-enabled discovery of phosphonate natural products and their biosynthetic pathways. J. Ind. Microbiol. Biotechnol.. 2014, s. 345–356. PMID 24271089.
- SF2312 is a natural phosphonate inhibitor of enolase. Nature Chemical Biology. 2016, s. 1053–1058. PMID 27723749.
- A. J. Wiemer; R. J. Hohl; D. F. Wiemer. The intermediate enzymes of isoprenoid metabolism as anticancer targets. Anti-Cancer Agents in Medicinal Chemistry. 2009, s. 526–542. PMID 19519294.