Trimethylfosfin
Trimethylfosfin je organická sloučenina se vzorcem P(CH3)3, zkráceně psaným jako PMe3. Jedná se o bezbarvou kapalinu se silním zápachem, podobným jako u ostatních alkylfosfinů. Používá se jako ligand v koordinační chemii.
| Trimethylfosfin | |
|---|---|
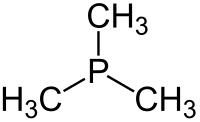
Strukturní vzorec | |
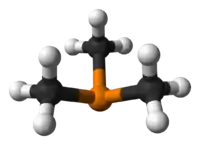
Model molekuly | |
| Obecné | |
| Systematický název | trimethylfosfan |
| Funkční vzorec | (CH3)3P |
| Sumární vzorec | C3H9P |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 594-09-2 |
| EC-no (EINECS/ELINCS/NLP) | 209-823-1 |
| PubChem | 68983 |
| ChEBI | 35890 |
| SMILES | CP(C)C |
| InChI | 1S/C3H9P/c1-4(2)3/h1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 76,077 g/mol |
| Teplota tání | −85 °C (188 K)[1] |
| Teplota varu | 37,5 °C (310,6 K)[1] |
| Hustota | 0,735 g/cm3 |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v dibutyletheru |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P271 P280 P302+352 P303+361+353 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P370+378 P403+233 P403+235 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
Tato sloučenina má pyramidální molekuly s grupou symetrie C3v. Úhly vazeb C–P–C jsou okolo 98,6°;[2] odpovídají tak tomu, že fosfor využívá k tvorbě vazeb převážně orbitaly 3p a téměř nedochází k sp hybridizaci atomu fosforu. Volný elektronový pár tak má převážně vlastnosti orbitalu s, podobně jako u fosfanu, PH3.[3]
PMe3 lze připravit reakcí trifenylfosfitu s methylmagnesiumchloridem:[4]
- 3 CH3MgCl + P(OC6H5)3 → P(CH3)3 + 3 C6H5OMgCl
Reakce se provádí v dibutyletheru, z něhož se těkavější PMe3 oddestiluje.
Reakce
Při pKa o hodnotě 8,65 reaguje PMe3 se silnými kyselinami vratně za vzniku solí [HPMe3]X.[2] Za přítomnosti silných zásad, jako jsou alkyllithných sloučenin se methylová skupina deprotonuje za tvorby PMe2CH2Li.
PMe3 lze snadno oxidovat kyslíkem na fosfinoxid. Reaguje s methylbromidem za tvorby tetramethylfosfoniumbromidu.[6]
Koordinační chemie
Trimethylfofosfin je silně zásaditý ligand, který může tvořit komplexy. Jako ligand má Tolmanův úhel 118°.[7] Tento úhel naznačuje míru sterické ochrany, kterou ligand poskytuje kovu, na nějž je navázán.
Na jeden atom kovu se může navázat více trimethylfosfinových ligandů, jako je tomu v komplexu Pt(PEt3)4.[8]
Komplex s jodidem stříbrným, AgI(PMe3), je na vzduchu stálá pevná látka, která zahřátím uvolňuje PMe3.
Bezpečnost
PMe3 je toxický a samozápalný. Lze jej přeměnit na bezpečnější fosfinoxid reakcí s chlornanem sodným nebo peroxidem vodíku.[9]
Reference
V tomto článku byl použit překlad textu z článku Trimethylphosphine na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/68983
- Annette Schier and Hubert Schmidbaur"P-Donor Ligands" in Encyclopedia of Inorganic Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/0470862106.ia177
- E. Fluck, The chemistry of phosphine, Topics in Current Chemistry Vol. 35, 64 pp, 1973.
- M. L. Leutkens; A. P. Sattelberger; H. H. Murray; J. D. Basil; J. P. Fackler. Trimethylphosphine. Inorganic Syntheses. 1990, s. 305–310. ISBN 9780470132593. DOI 10.1002/9780470132593.ch76.
- A. Sattler; G. Parkin. Formation of a cationic alkylidene complex via formal hydride abstraction: synthesis and structural characterization of [W(PMe3)4(η2-CHPMe2)H]X (X = Br, I). Chemical Communications. 2011, s. 12828–12830. DOI 10.1039/C1CC15457E. PMID 22048609.
- H. F. Klein. Inorganic Syntheses. [s.l.]: [s.n.], 1978. ISBN 9780470132494. DOI 10.1002/9780470132494.ch23. Kapitola Trimethylphosphonium Methylide (Trimethyl Methylenephosphorane), s. 138–140.
- G. L. Miessler and D. A. Tarr Inorganic Chemistry, 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6
- T. Yoshida, autor2 = T. Matsuda; S. Otsuka. Inorganic Syntheses. [s.l.]: John Wiley & Sons, 1990. ISBN 9780470132593. DOI 10.1002/9780470132593.ch32. Kapitola Tetrakis(Triethylphosphine)Platinum(0), s. 122–123.
- http://www.sigmaaldrich.com/catalog/product/aldrich/324116?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xorders-_-prodRecCold2-2
Externí odkazy
 Obrázky, zvuky či videa k tématu Trimethylfosfin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trimethylfosfin na Wikimedia Commons

