Oxid siřičitý
Oxid siřičitý (chemický vzorec SO2) je jedním ze dvou hlavních oxidů síry. Je to bezbarvý, štiplavě páchnoucí, jedovatý plyn. Má 2,26× větší hustotu než vzduch.
| Oxid siřičitý | |
|---|---|

Strukturní vzorec | |
3D model molekuly SO2 | |
| Obecné | |
| Systematický název | Oxid siřičitý |
| Anglický název | Sulfur dioxide |
| Německý název | Schwefeldioxid |
| Sumární vzorec | SO2 |
| Vzhled | bezbarvá kapalina nebo bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7446-09-5 |
| EC-no (EINECS/ELINCS/NLP) | 231-195-2 |
| Indexové číslo | 016-011-00-9 |
| PubChem | 1119 |
| SMILES | O=S=O |
| InChI | 1S/O2S/c1-3-2 |
| Číslo RTECS | WS4550000 |
| Vlastnosti | |
| Molární hmotnost | 64,065 g/mol |
| Teplota tání | −72,46 °C |
| Teplota varu | −10,02 °C |
| Hustota | 0,002 97 g/cm³ (plyn, 0 °C) 1,434 g/cm3 (kapalina, 0 °C) |
| Dynamický viskozitní koeficient | 0,550 8 cP (kapalina, −33,5 °C) 0,428 5 cP (kapalina, −10,5 °C) 0,393 6 cP (kapalina, 0,1 °C) 0,011 7 cP (plyn, 0 °C) 0,012 42 cP (plyn, 18 °C) 0,016 1 cP (plyn, 100 °C) 0,020 4 cP (200 °C) 0,024 5 cP (293 °C) 0,031 15 cP (490 °C) |
| Index lomu | nD= 1,410 (20 °C, kapalina) nD= 1,000 686 (0 °C, plyn) |
| Kritická teplota Tk | 157,2 °C |
| Kritický tlak pk | 7 880 kPa |
| Kritická hustota | 0,524 g/cm3 |
| Disociační konstanta pKa | 1,81 |
| Rozpustnost ve vodě | 22,8 g/100 ml (0 °C) 11,5 g/100 ml (20 °C) 2,1 g/100 ml (90 °C) |
| Rozpustnost v polárních rozpouštědlech |
methanol ethanol aceton |
| Relativní permitivita εr | 17,6 (kapalina, −20 °C) 15,8 (kapalina, 0 °C) 14,1 (kapalina, 20 °C) 2,1 (kapalina, −154 °C) 1,000 75 (plyn, 100 °C) |
| Van der Waalsovy konstanty stavové rovnice | a=0,671 4 Pam6mol−2 106•b= 56,36 m3 mol−1 |
| Ionizační energie | 12,34 eV |
| Struktura | |
| Tvar molekuly | lomená (120°) |
| Dipólový moment | 5,57×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −296,83 kJ/mol −320,5 kJ/mol (kapalina) |
| Entalpie tání ΔHt | 135 J/g |
| Entalpie varu ΔHv | 389 J/g |
| Entalpie rozpouštění ΔHrozp | −556,5 J/g (20 °C) |
| Standardní molární entropie S° | 248,1 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −300,19 kJ/mol |
| Izobarické měrné teplo cp | 0,607 JK−1g−1 (0 °C) 0,622 JK−1g−1 (25 °C) 0,665 JK−1g−1 (100 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H331 H314 |
| R-věty | R23, R34 |
| S-věty | S1/2, S9, S26, S36/37/39, S45 |
| NFPA 704 |  0
3
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Oxid siřičitý se průmyslově připravuje především spalováním síry
nebo pražením pyritu
Je též produktem hoření sulfanu (sirovodíku)
Na mokré cestě se dá připravit redukcí kyseliny sírové některými kovy, např. mědí
nebo rozkladem siřičitanů koncentrovanou kyselinou sírovou, například
Vlastnosti
Ve vodě se oxid siřičitý snadno rozpouští za vzniku tepla a kyseliny siřičité
patří tedy ke kyselinotvorným oxidům.
S kyslíkem reaguje za chladu pomalu, za zvýšených teplot rychleji za vzniku oxidu sírového
Katalyzátorem této reakce je oxid vanadičný nebo kovová platina.
Podobně reaguje s plynným chlorem za vzniku sulfurylchloridu
Za žáru ho lze vodíkem zredukovat na síru:
za nižších teplot může při této reakci vznikat i sulfan
Také vedením plynného oxidu siřičitého přes rozžhavený koks vzniká volná síra
Výskyt v přírodě
Oxid siřičitý se vyskytuje v sopečných plynech a rozpuštěný jako kyselina siřičitá v podzemních (minerálních) vodách ve vulkanicky aktivních oblastech. Jedná se o hojný sopečný plyn, který je vyvrhován při sopečné erupci, při silných erupcích se může dostat v pyroklastickém mračnu až do stratosféry, kde se společně se sulfanem a vodní párou podílí na vzniku drobných kapiček kyseliny sírové, tzv. aerosolu. Tento aerosol je schopen přetrvat ve stratosféře 2 až 3 roky a působí jako velice efektivní zábrana před dopadajícím slunečním zářením, čímž pomáhá v některých oblastech oteplovat a v dalších ochlazovat zemský povrch (v závislosti na velikosti částic aerosolu).[2]
V menším množství byl spektroskopicky zjištěn v atmosféře planety Venuše. Je též obsažen v plynech vyvrhovaných sopkami na Jupiterově měsíci Io.
Využití
Oxid siřičitý je základní surovinou pro výrobu kyseliny sírové. K této výrobě se připravuje buď spalováním síry nebo pražením pyritu a poté se katalyticky oxiduje na oxid sírový, jehož rozpouštěním ve vodě vzniká kyselina sírová. Jako katalyzátor se nejčastěji používá oxid vanadičný.
Protože má dezinfekční a bělící účinky, používá se k desinfekci (tzv. síření) sudů a sklepních prostor pro skladování ovoce a zeleniny, k ošetřování osiv proti plísním a na bělení přírodních materiálů. V menší míře se užívá i jako konzervační činidlo.
Fyziologické působení
Oxid siřičitý působí dráždivě zejména na horní cesty dýchací, dostavuje se kašel, v těžších případech může vzniknout až edém plic.
Menší koncentrace vyvolávají záněty průdušek a astma. Chronická expozice oxidu siřičitému negativně ovlivňuje krvetvorbu, způsobuje rozedmu plic, poškozuje srdeční sval, negativně působí na menstruační cyklus. Používá se jako konzervant, antioxidant a prostředek proti hnědnutí do vína, kukuřičného sirupu, želé, sušeného ovoce, džusů, nealkoholických ovocných nápojů, pečiva, octa, výrobků z brambor, koření a polévek. Přidává se také při výrobě džemů a marmelád. Dále se používá jako bělící přísada do želatiny a k bělení chmele, lecitinu, hub, ořechů, lepidla a řepného cukru.
Ekologické působení
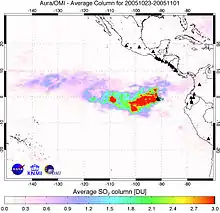
Značně toxický je oxid siřičitý pro rostliny, neboť reaguje s chlorofylem a narušuje tak fotosyntézu. V ovzduší pozvolna oxiduje vzdušným kyslíkem za přítomnosti vody na kyselinu sírovou, která je spolu s kyselinou siřičitou příčinou kyselých dešťů.
Z hygienického hlediska jsou nejvyšší přípustné koncentrace oxidu siřičitého ve vzduchu v průběhu 24 hodin 0,15 µg/m3 a krátkodobě 0,5 µg/m3.[zdroj?]
Oxid siřičitý vzniká jako vedlejší produkt při spalování méně kvalitního hnědého uhlí, které obsahuje jak volnou síru, tak některé sulfidy, zejména pyrit. Pro ochranu přírodního prostředí je proto nezbytné odsiřování kouře u elektráren, používajících toto palivo, jak vyžaduje zákon o ochraně ovzduší.[3] Nejčastěji se používá reakce oxidu siřičitého se suspenzí vápence ve vodě
- Oxid siřičitý reaguje s uhličitanem vápenatým a kyslíkem za vzniku oxidu uhličitého a síranu vápenatého.
při níž vzniká méně škodlivý oxid uhličitý a jako vedlejší produkt síran vápenatý (tzv. energosádrovec).
Podobně při spalování méně kvalitních benzinů nebo nafty, obsahujících sirné sloučeniny (zejména thiofen), v automobilových motorech se do vzduchu dostává oxid siřičitý; navíc přitom dochází k poškozování katalyzátorů ve výfukových potrubích.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Reference
- Sulfur dioxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- PARFITT, Elisabeth A.; WILSON, Lionel. Fundamentals of Physical Volcanology. [s.l.]: Blackwell Publishing company, 2009. Dostupné online. ISBN 978-0-63205443-5. Kapitola Volcanoes and climate: Satellite monitoring of climate change after volcanic eruptions, s. 182-183. (anglicky)
- (zákon č. 309/1991 Sb., novelizovaný zákonem č. 218/1992 Sb.)

