Manganistany
Manganistany jsou soli obsahující manganistanový anion MnO -
4 . Vzhledem k tomu, že v nich má mangan oxidační číslo +7, tak se jedná o silná oxidační činidla. Ion má tetraedrickou molekulovou geometrii.[1]
Roztoky manganistanů mívají růžové zabarvení a jsou stabilní v neutrálních až mírně zásaditých prostředích. Konkrétní reakce závisí na přítomnosti organických nečistot a látce, která je oxidována; například 1,1,1-trichlorethan (C2H3Cl3) reaguje za vzniku oxidu uhličitého (CO2), oxidu manganičitého (MnO2), vodíkových kationtů (H+) a chloridových aniontů (Cl−).[2]
- 8 MnO -
4 + 3 C2H3Cl3 → 6 CO2 + 8 MnO2 + H+ + 4 H2O + 9 Cl−
V kyselém prostředí se manganistany redukují na světle růžové manganaté soli:
- 8 H+ + MnO -
4 + 5 e− → Mn2+ + 4 H2O
V silně zásaditých roztocích jsou manganistany redukovány na manganany MnO 2-
4 .
- MnO -
4 + e− → MnO 2-
4
V neutrálních roztocích vzniká hnědý oxid manganičitý MnO2.
- 2 H2O + MnO -
4 + 3 e− → MnO2 + 4 OH−
Příprava a výroba
Manganistany lze připravit oxidací sloučenin manganu, jako jsou chlorid manganatý a síran manganatý, silnými oxidačními činidly, například chlornanem sodným nebo oxidem olovičitým:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl + 3 H2O
- 2 MnSO4 + 5 PbO2 + 3 H2SO4 → 2 HMnO4 + 5 PbSO4 + 2 H2O
Mohou také vznikat disproporcionací z mangananů, kde se tvoří také oxid manganičitý:
- 3 Na2MnO4 + 2 H2O → 2 NaMnO4 + MnO2 + 4 NaOH
Průmyslová výroba manganistanů spočívá v elektrolýze nebo vzdušné oxidaci zásaditých roztoků mangananů (MnO 2-
4 ).[3]

Vlastnosti
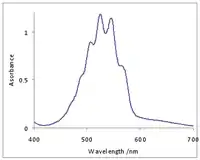
Manganistany jsou soli kyseliny manganisté. Mívají tmavě fialové zbarvení. Jedná se o silná oxidační činidla, podobná chloristanům, čehož se využívá při manganometrických titracích. Manganistany mohou teoreticky oxidovat vodu, což ale nebývá pozorováno.
Jde o užitečné reaktanty i v organické chemii, které ale nejsou příliš selektivní. Manganistan draselný se používá jako dezinfekce a k úpravě vody v akvakultuře.[4]
Manganistany nejsou příliš tepelně stabilní, například manganistan draselný se rozkládá při 230 °C na manganan draselný a oxid manganičitý za uvolnění kyslíku:
- 2 KMnO4 → K2MnO4 + MnO2 + O2
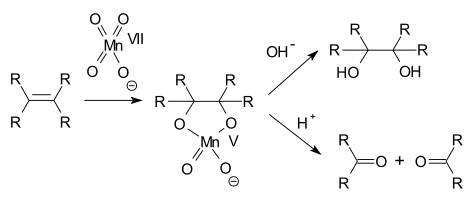
Manganistany mohou oxidovat například aminy na nitrosloučeniny,[5][6] alkoholy na ketony,[7] aldehydy na karboxylové kyseliny,[8][9] koncové alkeny na karboxylové kyseliny,[10] kyselinu šťavelovou na oxid uhličitý[11] a alkeny na dioly.[12]
Příklady sloučenin
- Manganistan amonný, NH4MnO4
- Manganistan vápenatý, Ca(MnO4)2
- Manganistan draselný, KMnO4
- Manganistan sodný, NaMnO4
- Manganistan stříbrný, AgMnO4
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Permanganate na anglické Wikipedii.
- Sabita Patel Sukalyan Dash; Bijay K. Mishra. Oxidation by permanganate: synthetic and mechanistic aspects. Tetrahedron. 2009, s. 707–739. DOI 10.1016/j.tet.2008.10.038.
- http://geocleanse.com/permanaganate.asp
- F. Albert Cotton; Geoffrey Wilkinson; Carlos A. Murillo; Manfred Bochmann. Advanced Inorganic Chemistry. New York: John Wiley & Sons, 1999. Dostupné online. ISBN 978-0471199571. S. 770.
- Potassium Permanganate Sodium Disinfectant [online]. Syndel. Dostupné online.
- A. CALDER, A. R. FORRESTER1, AND S. P. HEPBURN. 2-methyl-2-nitrosopropane and its dimer. Org. Synth.. 1972, s. 803. Dostupné online. (anglicky); Coll. Vol.. S. 77. (anglicky)
- NATHAN KORNBLUM AND WILLARD J. JONES. 4-nitro-2,2,4-trimethylpentane. Org. Synth.. 1963, s. 845. Dostupné online. (anglicky); Coll. Vol.. S. 87. (anglicky)
- J. W. CORNFORTH. Ethyl pyruvate. Org. Synth.. 1951, s. 467. Dostupné online. (anglicky); Coll. Vol.. S. 59. (anglicky)
- R. L. SHRINER AND E. C. KLEIDERER. Piperonylic acid. Org. Synth.. 1930, s. 538. Dostupné online. (anglicky); Coll. Vol.. S. 82. (anglicky)
- JOHN R. RUHOFF. n-heptanoic acid. Org. Synth.. 1936, s. 315. Dostupné online. (anglicky); Coll. Vol.. S. 39. (anglicky)
- DONALD G. LEE, SHANNON E. LAMB, AND VICTOR S. CHANG. Carboxylic acids from the oxidation of terminal alkenes by permanganate: nonadecanoic acid. Org. Synth.. 1981, s. 397. Dostupné online. (anglicky); Coll. Vol.. S. 11. (anglicky)
- K. A. Kovacs; P. Grof; L. Burai; M. Riedel. Revising the Mechanism of the Permanganate/Oxalate Reaction. The Journal of Physical Chemistry A. 2004, s. 11026. DOI 10.1021/jp047061u. Bibcode 2004JPCA..10811026K.
- E. J. WITZEMANN, WM. LLOYD EVANS, HENRY HASS, AND E. F. SCHROEDER. dl-glyceraldehyde ethyl acetal. Org. Synth.. 1931, s. 307. Dostupné online. (anglicky); Coll. Vol.. S. 52. (anglicky)