Chlornan sodný
Chlornan sodný je chemická sloučenina se sumárním vzorcem NaClO. Roztok chlornanu sodného, běžně známý jako chlorové bělidlo (SAVO), se často používá k dezinfekci a jako bělicí činidlo. Stabilní je pouze jako hydrát [2], nejčastěji se vyskytuje jako pentahydrát – NaClO·5H2O. Ten je stabilní pouze při teplotách nižších než 0 °C. Bezvodý chlornan sodný se prudce rozkládá.
| Chlornan sodný | |
|---|---|
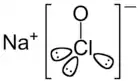
Vzorec | |
| Obecné | |
| Systematický název | Chlornan sodný |
| Triviální název | Labarraqueův louh |
| Anglický název | Sodium hypochlorite |
| Německý název | Natriumhypochlorit |
| Sumární vzorec | NaClO |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7681-52-9 |
| EC-no (EINECS/ELINCS/NLP) | 231-668-3 |
| Indexové číslo | 017-011-00-1 |
| PubChem | 24340 |
| UN kód | 1791 |
| Číslo RTECS | NH3486300 |
| Vlastnosti | |
| Molární hmotnost | 74,442 g/mol 164,519 g/mol (pentahydrát) |
| Teplota tání | 18 °C (pentahydrát) |
| Teplota rozkladu | 101 °C |
| Hustota | 1,2 g/cm3 |
| Rozpustnost ve vodě | 95,7 g/100 g (0 °C, pentahydrát) 149,94 g/100 g (10 °C, pentahydrát) 379,54 g/100 g (20 °C, pentahydrát) 849 g/100 g (24 °C, pentahydrát) |
| Struktura | |
| Krystalová struktura | kosočtverečná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −346 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 H400 EUH031 |
| R-věty | R31, R34, R50 |
| S-věty | S1/2, S28, S45, S50, S61 |
| NFPA 704 |  1
2
1
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Chlornan sodný a vedle něj chlorid sodný lze vyrobit zaváděním chloru do chladného a zředěného roztoku hydroxidu sodného. Roztok s nižší koncentrací chlornanu sodného lze průmyslově vyrobit elektrolýzou roztoku chloridu sodného s minimálním oddělením anody a katody. Teplota roztoku se musí udržovat pod 30 °C, aby se zamezilo tvorbě nežádoucího chlorečnanu sodného[3].
- 2NaOH + Cl2 → NaCl + NaClO + H2O
V koncentrovaném horkém roztoku hydroxidu se namísto chlornanu vytváří chlorečnan.
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O,
Hydroxid sodný a chlor se komerčně vyrábí chlor-alkalickým procesem a k přípravě chlornanu sodného je není potřeba izolovat. Chlor se tedy současně redukuje a oxiduje.
Komerční roztoky vždy obsahují významné množství chloridu sodného (kuchyňské soli) jako hlavního vedlejšího produktu, jak je vidět z výše uvedené rovnice. Například přípravek SAVO obsahuje do 5 % chlornanu sodného a 1 % chloridu sodného[4].
Balení a prodej
Domácí bělidlo prodávané pro účely bělení prádla je tří- až šestiprocentní roztok chlornanu sodného (v okamžiku výroby). Koncentrace se mezi různými výrobky liší a při dlouhodobém uskladnění postupem času klesá.
Obvykle používaný chlornan má 14 % až 17 % aktivního chloru, roztok se používá v úpravnách vody ke chloraci vody v bazénech a v menších vodárnách. Velké provozy používají nejčastěji přímo plynný chlor. Koncentrovaný roztok chlornanu vápenatého (označovaný také jako HTH, angl. High-test hypochlorite) je nabízen jako prostředek pro chlorování vody v bazénech a obsahuje přibližně 30 % chlornanu vápenatého. K témuž účelu se prodává také krystalická sůl; obvykle obsahuje méně než 50 % chlornanu vápenatého. Hladina "aktivního chloru" však může být vyšší.
Chlornan sodný lze najít na pultech také v podobně "denních sanitizačních sprejů", kde je aktivní složkou v koncentraci 0,009 5 %.
Použití
Bělení
V podobě domácího bělidla se chlornan sodný používá k odstraňování skvrn z prádla. Je účinný zvláště na bavlněných látkách, které se snadno špiní, ale jdou dobře bělit. Obvykle se doporučuje 50 až 250 ml na jednu standardní várku prádla. Vlastnosti domácího bělidla, které zajišťují účinnost při odstraňování skvrn, vedou však také ke kumulativnímu poškozování organických vláken, například bavlny, proto se bělením zkracuje užitečná životnost prádla. Stejně tak vlákna narušuje také hydroxid sodný, který (jak je uvedeno dále) je v domácím bělidle též obsažen. Není těkavý a nevypláchnutá zbytková množství NaOH pokračují za přítomnosti vlhkosti v pomalé degradaci organických vláken. Z těchto důvodu je dobré, pokud jsou skvrny lokalizovány, použít bělidlo jen místně, je-li to možné. Za náležité opatrnosti lze po bělení použít slabé organické kyseliny, například kyselinu octovou (ocet), k neutralizaci NaOH a uvolnit chlor ze zbytkového chlornanu. Stará trička a bavlněná prostěradla, která se trhají, snadno demonstrují následky praní s použitím bělidla. Horká voda zesiluje účinky a způsobuje tepelný rozklad chlornanu, který nakonec tvoří chlorečnany nebezpečné pro životní prostředí.
Dezinfekce
Fenolový koeficient chlornanu sodného se pohybuje od 42 do 300 v závislosti na konkrétním mikroorganismu. Koncentrace vodíkových iontů v roztoku má na hodnotu fenolového koeficientu malý nebo žádný vliv.[5]
Slabý roztok 1% chlornanu v teplé vodě se používá k sanitaci hladkých povrchů před výrobou piva nebo vína. Povrchy je potřeba opláchnout, aby se nápoje nedostaly nežádoucí pachutě; tyto chlorované vedlejší produkty sanitace jsou navíc škodlivé.
Americké předpisy (21 CFR Part 178) povolují použití roztoků obsahující chlornan sodný pro sanitaci zařízení a povrchů, které jsou ve styku s potravinami, za podmínky, že použitý roztok před kontaktem s potravinami dostatečně odteče a jeho koncentrace nepřesahuje 200 ppm volného chloru (například 4 ml typického domácího bělidla s 5 % chlornanu sodného na litr vody). Použije-li se vyšší koncentrace, musí se povrch po sanitaci opláchnout pitnou vodou.
Bělidlo v ředění 1 ku 5 s vodou (1 díl bělidla na 4 díly vody) je účinné proti mnoha bakteriím a některým virům. Často je dezinfekčním prostředkem volby při čištění povrchů v nemocnicích (hlavně v USA). Roztok je žíravý a musí se po použití důkladně odstranit, proto po dezinfekci chlornanem někdy následuje ethanolová dezinfekce. Komerční dezinfekční přípravky jako Virocidin-X obvykle obsahují chlornan sodný jako aktivní složku, navíc jsou ale jejich součástí tenzidy (ke zlepšení smáčivosti) a parfémující látky (pro zakrytí pachu chloru).
Úprava vody
Ve vodárnách a bazénech se dávkuje 2 až 10 ml/m³ vody komerčního chlornanu sodného o koncentraci 150 g aktivního chloru na 1 kg roztoku ( tj. 15% hm. ) – skutečnost v ČR. Chlornan sodný se v procesu úpravy bazénové vody využívá zejména pro navýšení koncentrace aktivního chloru v bazénových vodách nebo jako účinný čistič (přípravky s obsahem do 5% obsahu chlornanu sodného). Samotný chlornan sodný se pro účely úpravy bazénových vod dodává v několika jakostech a koncentracích. Nejlepší volbou z hlediska účinnosti přípravku a jeho stability v dlouhodobém časovém úseku je přípravek Chlornan sodný stabilizovaný ve vodárenské kvalitě (tj. standardně používaný při vodárenské úpravě vody pitné) o koncentraci 12 až 17% účinné látky. Použití více ředěných roztoků chlornanu sodného nebo aplikace roztoku chlornanu sodného v technické kvalitě pro zajištění žádoucí kvality bazénové vody není z dlouhodobého hlediska vhodné z důvodů vnášení nežádoucích nečistot (hlavně iontů železa, které způsobují hnědavé zbarvení bazénových stěn, plastových dílů a příslušenství) do bazénové vody a nutnosti většího spotřeby přípravků s nižší koncentrací účinné látky, což může být pro provozovatele domácích bazénů finančně nevýhodné.
Pro prvotní orientaci a zhodnocení vlastností konkrétního přípravku bazénové chemie na bázi aktivního chloru slouží následující doporučení: roztok chlornanu sodného pro úpravu bazénové vody je čirá, jasně žlutá kapalina o hustotě cca 1,25 kg/dm3 (uvedená hmotnost 1,25 kg přípravku odpovídá 1 l roztoku o koncentraci 12 až 17% účinné látky), s mírným chlorovým zápachem bez jakýchkoliv nežádoucích cizorodých pachů.
Chlornan sodný by v žádném případě neměl obsahovat žádné viditelné nerozpuštěné látky či usazeniny.
Pro šokovou chloraci nádrží nebo vodních systémů se používá 2% roztok. Pro větší systémy je praktičtější používat HTH, protože stačí menší dávky. Zásaditost chlornanových roztoků způsobuje srážení minerálů, například uhličitanu vápenatého, proto šokové chlorování často doprovází ucpávání systému. Sraženiny také chrání bakterie a snižují tak účinnost této metody.
Chlornan sodný se používá také k dezinfekci pitné vody, a to v koncentraci odpovídající 1 litru domácího bělidla na 4000 litrů vody. Přesné množství potřebné k dezinfekci závisí na chemickém složení vody, teplotě, kontaktním čase a přítomnosti/absenci sedimentu. Při aplikace velkého rozsahu se k zajištění správného dávkování měří zbytkový chlor v titrátu. Pro nouzovou dezinfekci EPA doporučuje použít dvě kapky pětiprocentního bělidla na čtvrt (amerického) galonu vody. Pokud upravovaná voda není cítit po chloru, přidají se další dvě kapky.
Používání dezinfekčních přípravků na bázi chloru k dezinfekci vody pro domácnosti, třebaže je velmi rozšířené, je do určité míry kontroverzní vzhledem k tvorbě malých množství škodlivých vedlejších produktů, například chloroformu.
Zásaditý roztok (pH 11) chlornanu sodného se používá k úpravě zředěných (< 1 g na litr) kyanidových odpadních vod, například oplachových vod z galvanického pokovování. Dávkovým způsobem se ošetřují koncentrovanější kyanidové odpady, kupř. roztoky pro postříbřování. Dobře promíšený roztok je plně ošetřen, pokud lze detekovat přebytek chloru.
Chlornan sodný v podobě domácího bělidla se často používá k oxidaci odporně páchnoucích thiolových odpadů z chemických laboratoří.
Endodoncie
Chlornan sodný se nyní používá v endodoncii pro ošetření kořenových kanálků. Je léčivem volby pro svou účinnost proti patogenním organismům a zahnívání dřeně. Historicky se používal půlprocentní Dakinův roztok. Běžná koncentrace pro použití v endodoncii se pohybuje od 0,5 do 5,25 %. Nižší koncentrace rozpouští především nekrotickou tkáň; vyšší koncentrace jsou sice účinnější, ale rozpouští i zdravou tkáň, což je obecně nežádoucí. Ukázalo se, že klinická účinnost se při koncentracích nad 1 % prokazatelně nezvyšuje.[6]
Oxidace
Chlornan sodný s katalyzátorem fázového přenosu podle zjištění oxiduje alkoholy na příslušné karbonylové sloučeniny.[7]
Mechanismus účinku
Viz článek kyselina chlorná.
Bezpečnost
Chlornan sodný je silný oxidant. Produkty oxidačních reakcí jsou žíravé. Roztoky NaClO, zvláště ve vyšších koncentracích, leptají kůži a poškozují oči. Ovšem podle NFPA se pouze roztoky s více než 40 % hmotnostními považují za nebezpečné oxidanty. Roztoky pod 40 % mají podle této klasifikace mírnou oxidační nebezpečnost (NFPA 430, 2000).
Domácí bělidlo a roztoky pro chlorování bazénů jsou typicky stabilizovány významným množstvím hydroxidu sodného (sodný louh, NaOH) jakožto součástí výrobní reakce. Kontakt s kůží způsobuje podráždění až poleptání prostřednictvím odmaštění a zmýdelnění kožních tuků a následně zničení tkáně. Pocit slizkosti (kluzkosti) bělidla na kůži je zapříčiněn tímto procesem.
Thiosíran sodný je účinným neutralizátorem chloru. Opláchnutí kůže roztokem o koncentraci 5 mg/l, s následným omytím vodou s mýdlem, rychle odstraní zápach chloru z rukou.
Chlorování pitné vody může oxidovat organické kontaminanty za vzniku trihalomethanů (haloformů), které jsou karcinogenní. Míra tohoto nebezpečí je předmětem spekulací.
Míšení bělídla s některými domácími čističi může být nebezpečné. Například míšení kyselého čističe s chlornanem způsobuje vývin plynného chloru. Při míšení s roztoky obsahujícími amoniak (včetně moči) se tvoří chloraminy. Jak chlor, tak plynné chloraminy jsou toxické. Chlornan sodný může bouřlivě reagovat s peroxidem vodíku za vzniku kyslíku:[8]
- H2O2(aq) + NaClO(aq) → NaCl(aq) + H2O(l) + O2(g)
Odhaduje se, že se ročně stane v britských domácnostech okolo 3300 nehod způsobených chlornanem sodným, které vyžadují hospitalizaci (RoSPA, 2002).
Čerstvá evropská studie ukázala, že chlornan sodný a organické chemikálie (například tenzidy, parfémující látky) obsažené v různých čisticích prostředcích pro domácnost spolu mohou reagovat za vzniku chlorovaných těkavých organických sloučenin (VOC).[9] Tyto chlorované sloučeniny se uvolňují během čištění, některé z nich jsou toxické a pravděpodobně jsou pro člověka karcinogenní. Podle studie se koncentrace těchto látek ve vnitřním prostředí významně zvyšují (8-52× u chloroformu, resp. 1-1170× u tetrachlormethanu, vůči běžnému množství v domácnosti) během použití výrobků obsahujících chlornan sodný. Zvýšení koncentrace těchto látek bylo nejnižší pro čisté bělidlo a nejvyšší pro výrobky ve formě "husté kapaliny a gelu". Pozorované významné zvýšení koncentrací některých VOC (zvláště tetrachlormethanu a chloroformu) indikuje, že chlornan sodný může být zdrojem, který je důležitý z hlediska inhalační expozice zmíněným sloučeninám. Přestože autoři tvrdí, že používání těchto čisticích prostředků může významně zvýšit riziko nádorových onemocnění,[10] tento závěr se ukazuje být hypotetický:
- Nejvyšší citovaná hladina koncentrace tetrachlormethanu (s domnělými nejvyššími obavami) je 459 mikrogramů na metr krychlový, čili 0,073 ppm nebo 73 ppb. Časově vážená průměrná koncentrace povolená OSHA pro osmihodinové období je 10 ppm,[11] tedy téměř 140× vyšší.
- Nejvyšší povolená špičková koncentrace (podle OSHA; pětiminutová expozice během 5 minut ve čtyřhodinovém období) je 200 ppm,[11] tedy dvakrát vyšší, než uváděná nejvyšší špičková úroveň (u horní části láhve se vzorkem obsahujícím chlornan a čisticí prostředek).
Další studie používání těchto výrobků a jiných možných expozičních cest (např. kožní) mohou odhalit další rizika. Ačkoliv autoři dále zmiňovali u těchto plynů poškozování ozónové vrstvy, velmi malá množství plynů, vznikajících popsaným způsobem, by se měla na tomto účinku podílet jen minimálně, v porovnání s jinými zdroji.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Reference
V tomto článku byl použit překlad textu z článku Sodium hypochlorite na anglické Wikipedii.
- Sodium hypochlorite. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- http://toxnet.nlm.nih.gov/cgi-bin/sis/search2/f?./temp/~Pe6B2x:1
- http://www.wet-team.cz/files/konference/2010/PV2010%20sbornik/21-Mejta,Janda,Bartos.pdf
- Archivovaná kopie. www.savo.eu [online]. [cit. 2015-09-18]. Dostupné v archivu pořízeném dne 2015-07-25.
- The phenol coefficient and relative disinfecting power of sodium hypochlorite
- Zehnder M, et al. Tissue dissolving capacity and antibacterial effect of buffered and unbuffered hypochlorite solutions. Oral Surg Oral Med Oral Pathol Oral Radio Endodon. 2002, roč. 94, s. 756. DOI 10.1067/moe.2002.128961.
- G. A. Mirafzal and A. M. Lozeva. Phase transfer catalyzed oxidation of alcohols with sodium hypochlorite. Tetrahedron Letters. 1998, roč. 39, čís. 40, s. 7263–7266. DOI 10.1016/S0040-4039(98)01584-6.
- Hydrogen Peroxide + Bleach Explanation [online]. [cit. 2008-12-13]. Dostupné v archivu pořízeném dne 2009-05-22.
- Odabasi, M., “Halogenated Volatile Organic Compounds from the Use of Chlorine-Bleach- Containing Household Products”, Environmental Science & Technology 42, 1445–1451, (2008). Available at: Environmental Science & Technology (ACS Publications)
- Odabasi, M., “Halogenated Volatile Organic Compounds from the Use of Chlorine-Bleach- Containing Household Products, Slide presentation (2008). Available at: Volatile Organic PPT|Chemical Compounds|Chlorine Bleach|Halogenated Volatile Organic Compounds|Volatile Organic Compounds: SlideWorld Medical PPT Search Engine
- Chemical Sampling Information – Carbon Tetrachloride. www.osha.gov [online]. [cit. 2009-06-04]. Dostupné v archivu pořízeném z originálu dne 2010-05-29.



