Manganistan draselný
Manganistan draselný, KMnO4, známý též pod označením hypermangan, je sloučenina manganu s černo-šedými krystalky, která se velmi dobře rozpouští ve vodě za vzniku fialového roztoku. V analytické chemii jsou roztoky KMnO4 jedním ze základních oxidimetrických činidel pro redoxní titrace v tzv. manganometrii. V lékařství se využívá pro své oxidační vlastnosti jako antiseptikum.
| Manganistan draselný | |
|---|---|
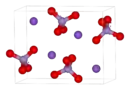
Buňka krystalové mřížky manganistanu draselného | |
 | |
| Obecné | |
| Systematický název | manganistan draselný |
| Triviální název | hypermangan |
| Latinský název | Kalii permanganas Kalium permanganicum |
| Anglický název | Potassium permanganate |
| Německý název | Kaliumpermanganat |
| Sumární vzorec | KMnO4 |
| Vzhled | fialová krystalická látka; temně růžový roztok |
| Identifikace | |
| Registrační číslo CAS | 7722-64-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-760-3 |
| Indexové číslo | 025-002-00-9 |
| PubChem | 24400 |
| UN kód | 1490 |
| Číslo RTECS | SD6475000 |
| Vlastnosti | |
| Molární hmotnost | 158,034 g/mol |
| Molární koncentrace cM | 0,394 mol/dm3 (6% roztok) |
| Teplota rozkladu | 240 °C (513 K) |
| Hustota | 2,703 8 g/cm3 (20 °C) 2,71 g/cm3 (25 °C) 1,039 g/cm3 (6% roztok) |
| Dynamický viskozitní koeficient | 0,985 cP (20 °C, 6% roztok) |
| Kinematický viskozitní koeficient | 0,948 cS (20 °C, 6% roztok) |
| Rozpustnost ve vodě | 2,82 g/100 g (0 °C) 7,63 g/100 g (25 °C) 12,5 g/100 g (40 °C) 25 g/100 g (65 °C) |
| Měrná magnetická susceptibilita | 2,26×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | kosočtverečná |
| Hrana krystalové mřížky | a= 910,5 pm b= 572 pm c= 742,5 pm |
| Koordinační geometrie | tetraedr |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −837,6 kJ/mol |
| Entalpie rozpouštění ΔHrozp | 275,6 J/g |
| Standardní molární entropie S° | 171,8 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −738 kJ/mol |
| Izobarické měrné teplo cp | 0,744 JK−1g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H272 H302 H410 |
| R-věty | R8, R22, R50/53 |
| S-věty | S2, S60, S61 |
| NFPA 704 |  0
2
0
OX
|
| Teplota vznícení | nehořlavý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fyzikálně-chemické vlastnosti

Manganistan draselný je dobře rozpustný ve vodě za vzniku temně fialového (při nízké koncentraci růžového) roztoku. Díky silným oxidačním vlastnostem manganistanu dochází pomalu k jeho částečnému rozkladu na oxid manganičitý (MnO2) a z vody se uvolňuje kyslík. Při delším stání roztoku je rozklad manganistanu znatelný a na dně se objevuje černý prášek oxidu manganičitého. Rozpustný je manganistan draselný dále v kyselině sírové (H2SO4), vodném roztoku kyseliny dusičné (HNO3(aq)) a acetonu (CH3COCH3). Kyselinu chlorovodíkovou (HCl) oxiduje manganistan na chlór a ethanol (CH3CH2OH) na oxid uhličitý. Jeho reakce s peroxidem vodíku lze využít k přípravě kyslíku. Manganistan se při této reakci redukuje na burel.
2 KMnO4 + 3 H2O2 → 2 MnO2 + 2 KOH + 3 O2 + 2 H2O
Příprava
Manganistan draselný je vyráběn ve velkém měřítku, kvůli jeho univerzálnímu použití v laboratořích. V první fázi pyrolýzy, v níž je oxid manganičitý ve své přirozené podobě, je tento taven s hydroxidem draselným a zahříván v atmosféře s dusičnanem draselným (zdroj kyslíku). Takto vznikne manganan draselný, který při elektrolýze v alkalickém roztoku přechází v manganistan draselný.
2 MnO2 + 4 OH− + O2 → 2 MnO42− + 2 H2O
2 MnO42− + Cl2 → 2 MnO4− + 2 Cl−
Manganistany mohou být připraveny smícháním roztoků Mn2+ kationtů s velmi silným oxidačním činidlem, které ochotně přidá dioxid, PbO2 nebo NaBiO3. Tyto reakce byly používány pro testování přítomnosti manganu očekávaného ve formě fialové barvy manganistanu.
Využití
Téměř všechny způsoby využití manganistanu draselného jsou odvozeny od toho, že je oxidační činidlo použitelné v různých chemických reakcích v laboratořích i v průmyslu. Díky svým oxidačním vlastnostem se využívá v lékařství jako antiseptikum. Dobře dezinfikuje a vysouší. Účinně působí proti plísním.[2]
Oxidace glycerinu pomocí manganistanu draselného probíhá podle následující rovnice, reakce probíhá velmi bouřlivě.[3]
14 KMnO4 + 4 C3H8O3 → 7 K2CO3 + 7 Mn2O3 + 5 CO2 + 16 H2O
V laboratoři se také používá pro získání kyslíku rozkladem peroxidu vodíku.
2 KMnO4 + 3 H2O2 → 2 MnO2 + 2 KOH + 3 O2 + 2 H2O
Bezpečnost
Pevný KMnO4 je silné oxidační činidlo, ale hlavně by měl být oddělený od látek, které by mohly zrezavět (Fe atd.). Zředěný vodný roztok KMnO4 není nebezpečný. KMnO4 vytváří nebezpečné sloučeniny s koncentrovanými kyselinami. Například reakce s koncentrovanou H2SO4 produkuje vysoce reaktivní oxid manganistý, explozi iniciuje i malé množství organických látek. Při smíšení pevného KMnO4 s čistým glycerolem se směs bouřlivě vznítí.
Jako oxidační činidlo manganistan draselný poskvrní ruce a oblečení, protože probíhá redukce na MnO2. Skvrny na oblečení mohou být odstraněny použitím kyseliny octové. Skvrny na pokožce, které jsou typicky hnědé, zmizí během 48 hodin či se dají odstranit kyselinou citronovou.
Podobné sloučeniny
- Manganistan sodný
- Manganan draselný (K2MnO4)
- Technecistan draselný
- Rhenistan draselný
- Kyselina manganistá
- Oxid manganistý
Reference
V tomto článku byl použit překlad textu z článku Potassium permanganate na anglické Wikipedii.
- Potassium permanganate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Dezinficiencia a antiseptika – WikiSkripta. www.wikiskripta.eu [online]. [cit. 2021-04-30]. Dostupné online.
- Nechte na zahradě explodovat sopku. Lidovky.cz [online]. 2008-04-26 [cit. 2020-04-29]. Dostupné online.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu manganistan draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu manganistan draselný na Wikimedia Commons



