Difluorid kyslíku
Difluorid kyslíku OF2 je vysoce toxická plynná látka světle žluté barvy, která obsahuje kyslík v oxidačním čísle +2. Název oxid fluorný není správný, protože fluor má větší elektronegativitu než kyslík.
| Difluorid kyslíku | |
|---|---|
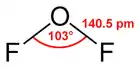
Vzorec | |
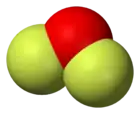
3D vzorec | |
| Obecné | |
| Systematický název | Difluorid kyslíku |
| Anglický název | Oxygen difluoride |
| Německý název | Sauerstoffdifluorid |
| Sumární vzorec | OF2 |
| Vzhled | Světle žlutý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-41-7 |
| Vlastnosti | |
| Molární hmotnost | 53,996 g/mol |
| Teplota tání | −223,8 °C |
| Teplota varu | −144,8 °C |
| Hustota | 1,91 g/cm³ (kapalina) |
| Kritická teplota Tk | −58 °C |
| Kritický tlak pk | 4 950 kPa |
| Kritická hustota | 0,553 g/cm3 |
| Rozpustnost ve vodě | rozklad |
| Ionizační energie | 13,6 eV |
| Struktura | |
| Tvar molekuly | Lomený |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 23 kJ/mol |
| Entalpie varu ΔHv | 205,4 J/g |
| Standardní molární entropie S° | −59,5 J K−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 40,6 kJ/mol |
| Izobarické měrné teplo cp | 0,802 J K−1 g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | ? |
| S-věty | ? |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Čistý je stálý, ve skleněných nádobách ho lze uchovávat až do 200 °C.[2] S vodou reaguje pomalu za vzniku kyseliny fluorovodíkové, reakce s vodní parou však probíhá explozivně. Při inicializaci jiskrou však výbušně reaguje s vodíkem nebo plynnými uhlovodíky, v přítomnosti dalších halogenů exploduje i bez inicializace.
Příprava
Poprvé byl připraven v roce 1929 elektrolýzou taveniny fluoridu draselného a kyseliny fluorovodíkové v přítomnosti malého množství vody.[3][4] V současnosti se připravuje zaváděním plynného fluoru do 2% roztoku hydroxidu sodného nebo elektrolýzou vodného roztoku kyselého fluoridu draselného KHF2.
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
Reaktivita
Difluorid kyslíku je silné oxidační činidlo díky kyslíku v oxidačním stavu +2. Při teplotách nad 200 °C se radikálově rozkládá na prvky.
Reaguje s mnoha kovy za vzniku oxidů a fluoridů. Při reakci s fosforem poskytuje směs PF5 a POF3. Také reaguje s xenonem za vzniku XeF4 a oxid-fluoridů xenonu.
S vodou reaguje pomalu za vzniku kyseliny fluorovodíkové:
- OF2(aq) + H2O(aq) → 2 HF(aq) + O2(g)
Využití
Jeho potenciální praktické uplatnění spočívá v raketové technice jako okysličovadlo.
Bezpečnost
OF2 je kvůli svým silným oxidačním vlastnostem velmi nebezpečná látka.
Reference
- Oxygen difluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Greenwood N.N., Earnshaw A.: Chemie prvků, Praha: Informatorium 1993, ISBN 80-85427-38-9
- Lebeau, P.; Damiens, A. "A New Method for the Preparation of the Fluorine Oxide” Compt. rend. 1929, volume 188, 1253-5.
- Lebeau, P.; Damiens, A. „The Existence of an Oxygen Compound of Fluorine“ Compt. rend. 1927, volume 185, pages 652–4.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Difluorid kyslíku na Wikimedia Commons
Obrázky, zvuky či videa k tématu Difluorid kyslíku na Wikimedia Commons


