Jodistan sodný
Jodistan sodný je anorganická sloučenina, sodná sůl kyseliny jodisté. Stejně jako mnohé další jodistany existuje ve dvou formách: jako jodistan monosodný (NaIO4) a jodistan pentasodný (Na5IO6). Obě tyto soli jsou užitečná oxidační činidla.[2]
| Jodistan sodný | |
|---|---|
Strukturní vzorec | |
| Obecné | |
| Systematický název | Jodistan sodný |
| Anglický název | Sodium periodate |
| Německý název | Natriumperiodat |
| Sumární vzorec | NaIO4 (bezvodý) |
| Vzhled | bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7790-28-5 |
| PubChem | 23667635 |
| SMILES | [O-]I(=O)(=O)=O.[Na+] |
| InChI | 1S/HIO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
| Číslo RTECS | SD4550000 |
| Vlastnosti | |
| Molární hmotnost | 213,8918 g/mol |
| Teplota tání | 300 °C (573 K) (bezvodý) |
| Teplota rozkladu | 175 °C (448 K) (trihydrát) |
| Rozpustnost ve vodě | rozpustný |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v kyselinách |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Jodistan sodný se nejčastěji vyrábí jako dihydrogenjodistan trisodný (Na3H2IO6).[3] Lze jej vyrobit oxidací jodičnanů chlorem a hydroxidem sodným:
- NaIO3 + Cl2 + 4 NaOH → Na3H2IO6 + 2 NaCl + H2O
- NaI + 4 Br2 + 10 NaOH → Na3H2IO6 + 8 NaBr + 4 H2O
Moderní průmyslová výroba spočívá v elektrochemické oxidaci jodičnanů na anodě z PbO2:
- IO -
3 + 3 H2O → H5IO6 + H+ + 2 e− E° = -1,6 V
Monojodistan sodný může být připraven dehydratací dihydrogenjodistanu trisodného kyselinou dusičnou[3]:
- Na3H2IO6 + 2 HNO3 → NaIO4 + 2 NaNO3 + 2 H2O
Struktura
Monojodistan sodný tvoří tetragonální krystaly (prostorová grupa I41/a) skládající se z lehce pokřivených iontů IO -
4 s průměrnou délkou vazby I-O 177,5 pm; ionty Na+ jsou obklopeny osmi kyslíkovými atomy ve vzdálenostech 254 a 260 pm.[4]
Dihydrogenjodistan trisodný utváří kosočtverečné krystaly (prostorová grupa Pnnm). Atomy jodu i sodíku jsou obklopeny osmistěnným seskupením šesti kyslíkových atomů; osmistěn NaO6 je ovšem silně pokřivený. Skupiny IO6 a NaO6 jsou propojeny společnými vrcholy a okraji.[5]
Práškovou difrakcí bylo zjištěno, že Na5IO6 vytváří jednoklonné krystaly (prostorová grupa C2/m).[6]
Použití
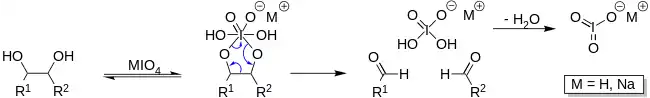
Roztok jodistanu sodného může být použit k otevření sacharidových kruhů mezi vicinálními dioly za odštěpení dvou aldehydových skupin. Tato reakce se často používá při značkování sacharidů fluorescenčními molekulami nebo jinými látkami jako je biotin. Jelikož je pro tento proces potřeba vicinální diol, využívá se často k selektivnímu značkování 3'-konců RNA (ribóza má vicinální diolové skupiny), ne u DNA (deoxyribóza vicinální dioly nemá).
NaIO4 se používá v organické chemii k rozštěpení diolů za vzniku dvou aldehydů[7]
Reference
V tomto článku byl použit překlad textu z článku Sodium periodate na anglické Wikipedii.
- Sodium periodate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Andrew G. Wee, Jason Slobodian, Manuel A. Fernández-Rodríguez and Enrique Aguilar "Sodium Periodate" e-EROS Encyclopedia of Reagents for Organic Synthesis 2006
- RILEY, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. Handbook of preparative inorganic chemistry. Volume 1. 2nd. vyd. New York, N.Y.: Academic Press, 1963. ISBN 012126601X. S. 323–324. (anglicky)
- KÁLMÁN, A.; CRUICKSHANK, D. W. J. Refinement of the structure of NaIO4. Acta Crystallographica Section B. 15 November 1970, s. 1782–1785. DOI 10.1107/S0567740870004880. (anglicky)
- JANSEN, Martin; REHR, ANETTE. Na2H3IO6, eine Variante der Markasitstruktur. Zeitschrift für anorganische und allgemeine Chemie. 1988, s. 95–100. DOI 10.1002/zaac.19885670111. (German)
- BETZ, T.; HOPPE, R. Über Perrhenate. 2. Zur Kenntnis von Li5ReO6 und Na5ReO6 – mit einer Bemerkung über Na5IO6. Zeitschrift für anorganische und allgemeine Chemie. May 1984, s. 19–33. DOI 10.1002/zaac.19845120504. (German)
- MCMURRY, John. Organic chemistry. 8th ed., [international ed.]. vyd. Singapore: Brooks/Cole Cengage Learning ISBN 9780840054531. S. 285–286. (anglicky)





