Nicolaouova totální syntéza taxolu
Nicolaouova totální syntéza taxolu je způsob totální syntézy taxolu, kterou vyvinul se svými spolupracovníky K. C. Nicolaou v roce 1994.[1] Taxol je významným léčivem, ovšem také velmi drahým, protože se získává z vzácného zdroje, kterým je tis západoamerický (Taxus brevifolia).
Tento postup je jedním z několika způsobů syntetické výroby taxolu; existují i další syntézy, například Holtonova, což je lineární syntéza vycházející z borneolu, Danishefského, kde je výchozí látkou Wielandův–Miescherův keton, a Wenderova začínající pinenem.
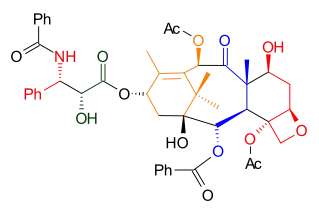
Nicolaouova syntéza je konvergentní, protože se výsledná molekula vytváří ze tří předpřipravených bloků. Dvěma hlavními částmi jsou cyklohexenové kruhy A a C propojené dvojicí krátkých můstků za tvorby osmičlenného kruhu (kruhu B). Třetí předem vytvořenou částí je amidový řetězec. Kruh D je oxetan napojený na kruh C. Klíčovými přeměnami jsou při této syntéze Shapirova reakce a pinakolové párování.[2]
Syntéza byla uveřejněna v roce 1995 ve čtveřici článků.[3][4][5][6]
Retrosyntéza
Taxol vzniká tvorbou esterových vazeb z diolu 7.2. Tento diol se vytváří z karbonátu 6.3 adicí fenyllithia. Oxetanový kruh sloučeniny 6.3 byl získán SN2 reakcí mesylátu odvozeného od acetalu 4.9. Kruh B se uzavřel McMurryovou reakcí dialdehydu 4.8, odvozeného od aldehydu 4.2 a hydrazonu 3.6 Shapirovou reakcí.
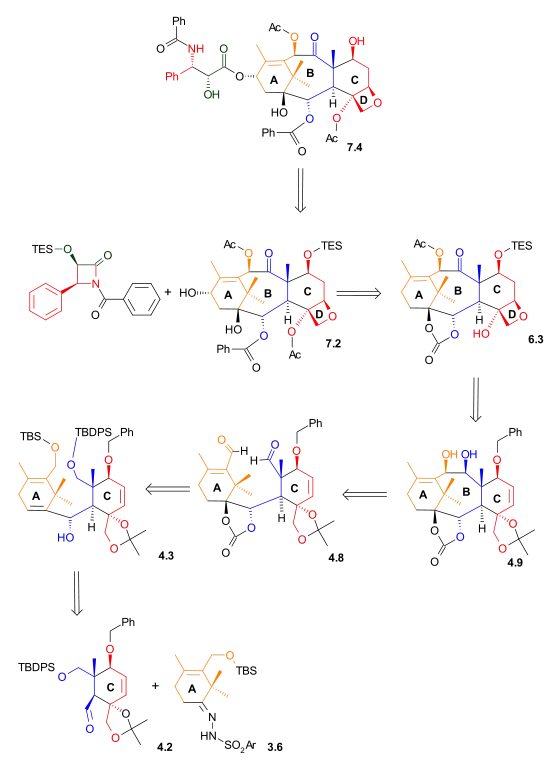 |
| Retrosyntéza - obrázek 1 |
|---|
Na následujícím obrázku je znázorněno, že aldehyd i hydrazon použité v Shapirove reakci byly vytvořeny Dielsovými–Alderovými reakcemi.
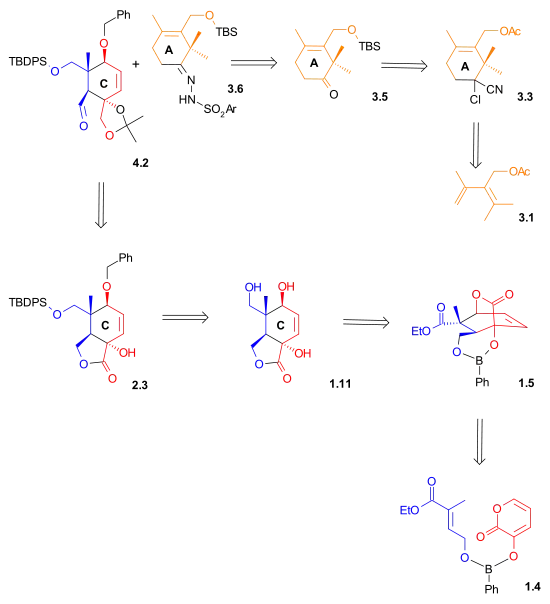 |
| !Retrosyntéza - obrázek 2 |
|---|
Syntéza kruhu C
Syntéza kruhu C začíná Dielsovou-Alderovou reakcí dienu 1.3 a dienofilu 1.1 za přítomnosti fenylboronové kyseliny (1.2), kde po přidání 2,2-dimethyl-propan-1,3-diolu vznikl pětičlenný lakton 1.8 se 62% výtěžností. Po navázání terc-butyldimethylsilyletherů (sloužících jako chránicí skupiny) na hydroxyly proběhne redukce esteru hydridem lithnohlinitým a selektivní oddělení chránicí skupiny ze sekundárního hydroxylu za tvorby laktondiolu 1.11. Tento lakton je hydratován 1.9 a izoluje se meziprodukt 1.10.
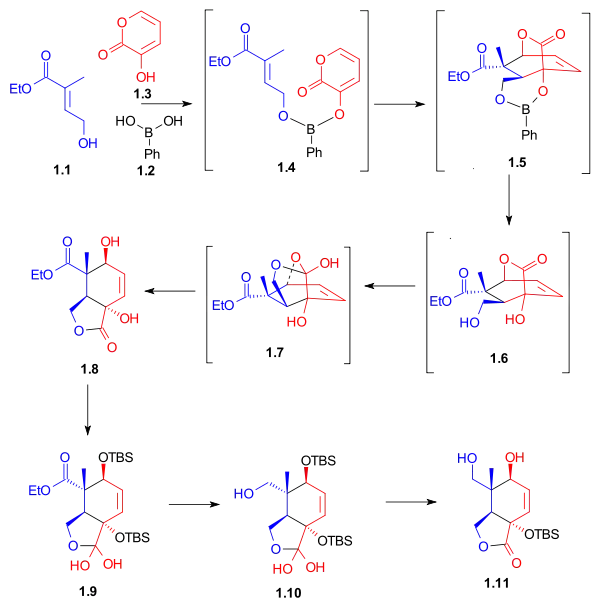 |
| Syntézy kruhů - obrázek 1 |
|---|
Laktondiol 2.1 je po navázání chránicí skupiny selektivně redukován hydridem lithnohlinitým na triol 2.4. Tento triol je po přeměně na acetonid oxidiován na aldehyd pomocí ruthenistanu tetrapropylamonného a N-methylmorfolin-N-oxidu. Aldehyd 2.6 slouží jako výchozí látka pro syntézu kruhu B (Syntézy kruhů - obrázek 4, sloučenina 4.2).
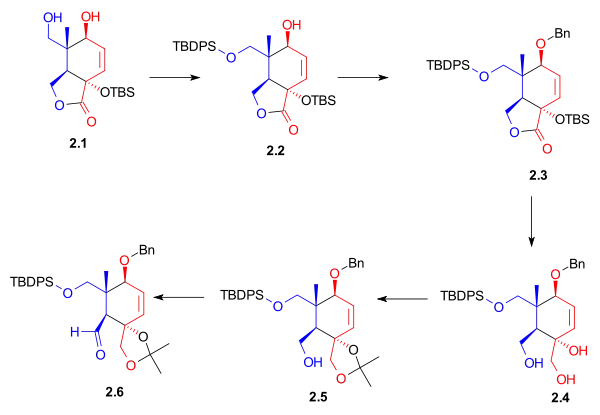 |
| Syntézy kruhů - obrázek 2 |
|---|
Syntéza kruhu A
Syntéza kruhu A začíná Dielsovou-Alderovou reakcí dienu 3.1 s 2-chlorakrylonitrilem 3.2, jejímž produktem je derivát cyklohexenu 3.3 s již hotovou regioselektivitou. hydrolýzou kyanochloroskupiny a současním odštěpením acetátové skupiny vzniká hydroxyketon 3.4. Hydroxylová skupina je ochráněna jako terc-butyldimethylsilylether (3.5). V rámci přípravy na Shapirovu reakci se tento keton přemění na hydrazon 3.6.
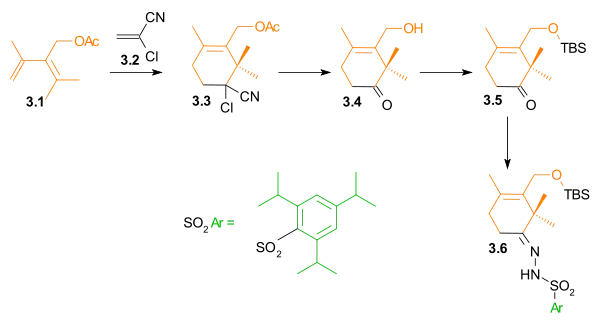 |
| Syntézy kruhů - obrázek 3 |
|---|
Syntéza kruhu B
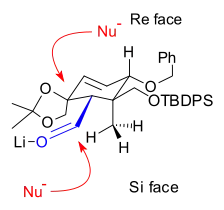
Spojením kruhů A a C se vytváří osmičlenný kruh B. Jedno ze spojení se vytvoří nukleofilní adicí vinyllithné sloučeniny na aldehyd a druhé pinakolovým párováním dvou aldehydů.
Shapirovou reakcí vinyllithné sloučeniny odvozené od hydrazonu 4.1 s aldehydem 4.2 vznikne první spojení vytvářející kruh B. Stereoselektivita 4.3 je pravděpodobně způsobena interakcemi vyvolávanými Si stranou, protože se nachází blízko axiální methylové skupiny. Epoxidační reakcí s vanadylacetylacetonátem se alken 4.3 změní na epoxid 4.4, jenž po redukci hydridem lithnohlinitým utvoří diol 4.5. Tento diol se poté ochrání jako karbonátový ester 4.6. Oddělí se silyletherové skupiny a diol 4.7 je zoxidován N-methylmorfolin-N-oxidem a ruthenistanem tetrapropylamonným na dialdehyd 4.8. V posledním kroku této části syntézy proběhne pinakolové párování za přítomnosti chloridu titanitého a slitiny zinku s mědí, jehož produktem je diol 4.9.
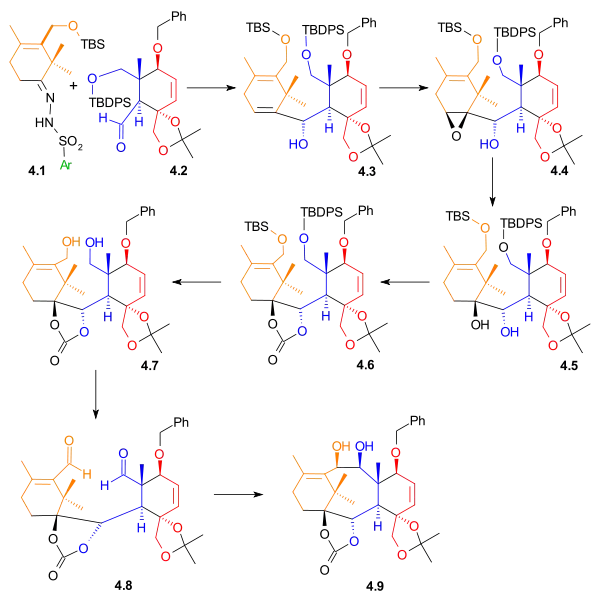 |
| Syntézy kruhů - obrázek 4 |
|---|
Rozlišení
V této části syntézy se vytvořil racemický meziprodukt. Získání potřebného enantiomeru se dosáhne acylací allylového alkoholu 4.9 (1S)-(−)-kamfanchloridem a 4-dimethylaminopyridinem, čímž vzniknou dva diastereomery, jež jsou dásledně od sebe odděleny sloupcovou chromatografií a potřebný enantiomer se odizoluje reakcí diastereomerů rotokem hydrogenuhličitanu draselného v methanolu.
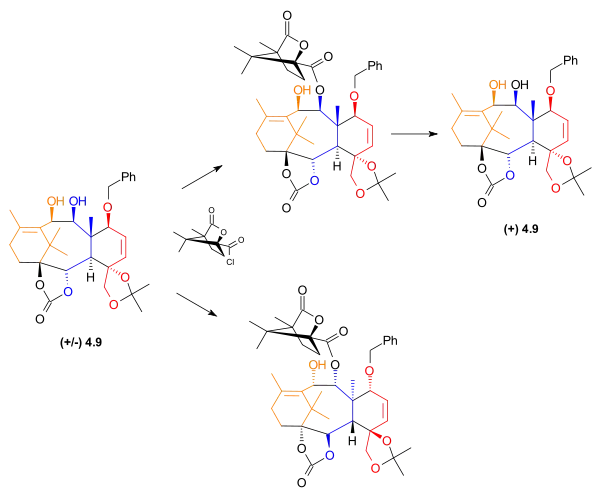 |
| Enantiomení rozlišení 4.9 |
Syntéza kruhu D
Enantiomer allylalkoholu získaný rozlišením 5.1 se acetyluje acetanhydridem a 4-(dimethylamino)pyridinem v chlormethanu za vzniku monoacetátu 5.2; tato reakce probíhá pouze na allylalkoholu a sousední hydroxyl se neacetyluje. Alkohol 5.2 se poté oxiduje ruthenistanem tetrapropylamonným a N-methylmorfolin-N-oxidem na keton 5.3. Alken se hydroboruje v tetrahydrofuranu. Oxidací peroxidem vodíku za přítomnosti hydrogenuhličitanu sodného vznikne alkohol 5.4 s 35% celkovou výtěžností a 15% výtěžností potřebného regioizomeru. Odstraněním acetonidu se následně vytvoří triol 5.5, který je monoacetylován na acetát 5.6. Benzylová skupina je odstraněna a nahrazena triethylsilylovou. Diol 5.7 se selektivně aktivuje methansulfonylchloridem a 4-(dimethylamino)pyridinem na mesylát 5.8, s výtěžností 78 %.
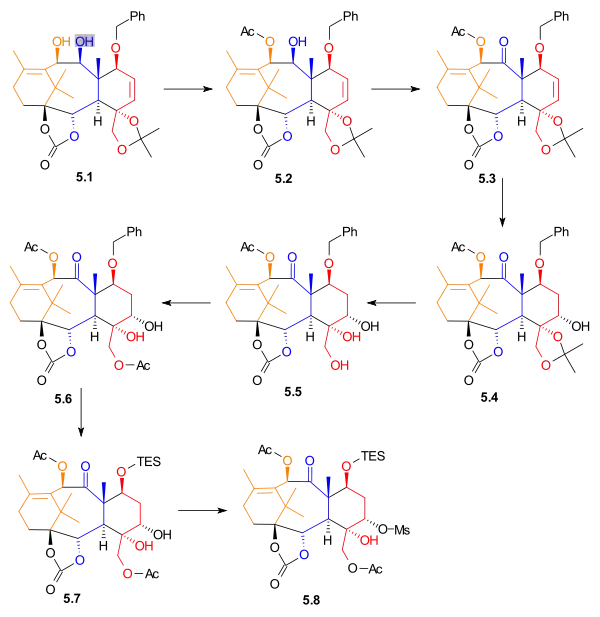 |
| Syntéza kruhů - obrázek 5 |
|---|
Acetylová skupina u 6.1 se odstraní za tvorby primárního alkoholu 6.2. Taxolový kruh (D) se naváže vnitromolekulární nukleofilní substitucí na oxetan 6.3. Po acetylaci se použije fenyllithium k otevření kruhu karbonátu za vzniku alkoholu 6.5. Allylovou oxidací pyridiniumchlorchromátem, octanem sodným a křemelinou se vytvoří keton 6.6, jenž se redukuje tetrahydridoboritanem sodným na sekunfární alkohol 6.7.
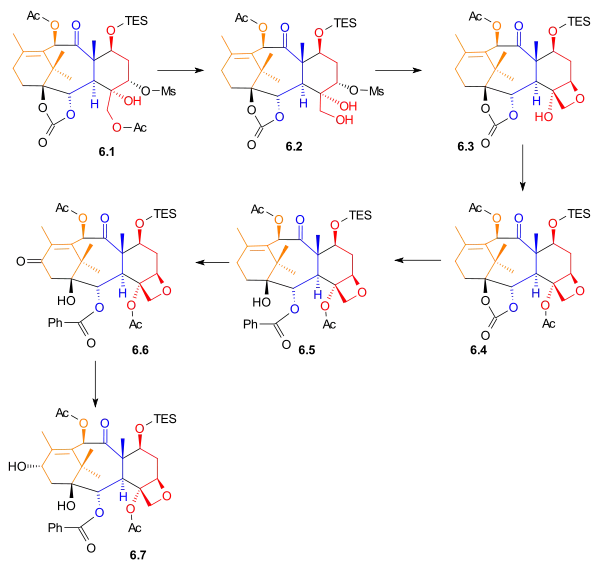 |
| Sytéza kruhů - obrázek 6 |
|---|
Navázání vedlejšího řetězce
Odžimův laktam 7.1 reaguje s alkoholem 7.2 za přítomnosti bis(trimethylsilyl)amidu sodného jako zásady; zde použitým alkoholem je triethylsilylether přírodní sloučeniny baccatinu III, podobná sloučenina 10-deacetylbaccatin III, se vyskytuje v tisu červeném s koncentrací v listech okolo 1 gramu na kilogram.
Odstraněním triethylsilylové chránicí skupiny vznikne taxol.
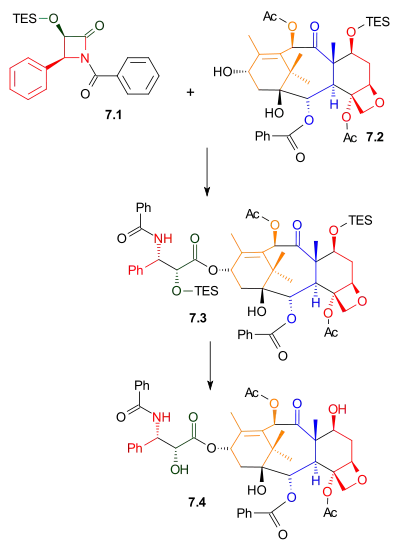 |
| Navázání postranního řetězce |
|---|
Příprava prekurzorů
Dienofil pro tvorbu kruhu C
Ethylester kyseliny propionové (1) je bromován a poté přeměněn na Wittigovo činidlo reakcí s trifenylfosfinem. Aldehyd 6 se vytvoří z allylalkoholu (4) navázáním terc-butyldifenylsilyletherové skupiny (5) a následnou ozonolýzou. Wittigovo činidlo 3 a aldehyd 6 se zúčastní Wittigovy reakce za vzniku nenasyceného esteru 7, z něhož se odštěpí chránicí skupina, čímž vznikne dienofil 8.
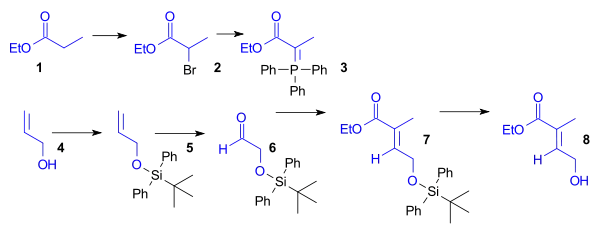
Příprava dienu pro tvorbu kruhu A
Aldolovou kondenzací acetonu a ethylacetacetátu vzniká β-ketoester 3. Grignardovou reakcí se zapojením methylmagnesiumbromidu se vytvoří alkohol 4, u něhož proběhne kysele katalyzovaná eliminace za vzniku dienu 5. Redukcí a acylací se poté vytvoří dien 7.
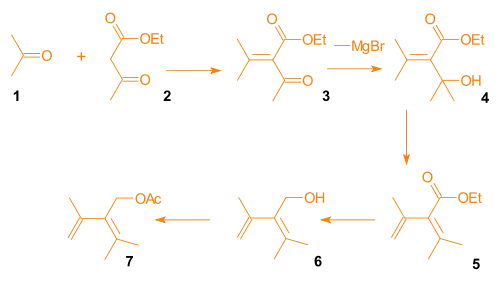
Chránicí skupiny
Ac (acetyl)
Navázání: Acetanhydrid, pyridin, 4-(dimethylamino)pyridin, dichlormethan
Odstranění: uhličitan draselný v methanolu vodě
Brání mesylaci primárního kyslíku u 5.8.
Acetonid
Navázání: 2,2-dimethoxypropan, kyselina kamforsulfoová a dichlormethan
Odstranění: kyselina chlorovodíková, methanol, voda, diethylether
Ochrana vicinálního diolu 2.4umožňuje selektivně oxidovat hydroxylovou skupinu alkoholu 2.5 na aldehyd 2.6. Acetonid byl odštěpen až později během přípravy uzavírání kruhu D.
Bn (benzyl)
Navázání: hydrid draselný, jodid tetra-n-butylamonný a benzylbromid
Odstranění: Vodík, Pd(OH)2/C
Sekundární alkohol 2.2 byl ochráněn jako benzylether a tak mohla být provedena redukce laktonu 2.3. Benzyl byl odstraněn později při tvorbě alkoholu 5.7, který byl zpětně ochráněn jako triethylsilylether.
Karbonátový ester
Navázání: Hydrid draselný, fosgen
Odstranění: Fenyllithium otevírá kruh karbonátu za vzniku alkoholu 6.5.
Ochrana zde usnadňuje tvorbu diolu 4.9 pinakolovým párováním a rovněž brání oxidaci při tvorbě dialdehydu 4.8.
Navázání: terc-butyldifenylsilylchlorid, imidazol a dimethylformamid
Odstranění: tetra-n-butylamoniumfluorid
Primární alkohol 2.1 byl ochráněn v rámci přípravy redukce laktonu v 2.3. Po odstranění chránicí skupiny před pinakolovým párováním se vytvořil diol 4.7.
TBS (terc-butyldimethylsilyl) [1]
Navázání: terc-butyldimethylsilyltriflát, lutidin, 4-(dimethylamino)pyridin a dichlormethan
Odstranění: kyselina kamforsulfonová, dichlormethan, methanol.
Sekundární hydroxyl u 1.8 byl chráněn současně s terciárním hydroxylem.
TBS (terc-butyldimethylsilyl) [2]
Navázání: terc-butyldimethylsilyltriflát, lutidin, 4-(dimethylamino)pyridin a dichlormethan
Odstranění: kyselina kamforsulfonová
Ochrana terciárního hydroxylu u 1.8 byla nutná k dosažení selektivní ochrany dalších hydroxylů na kruhu C.
TBS (terc-butyldimethylsilyl) [3]
Navázání: dichloromethan, imidazol a terc-butyldimethylsilylchlorid
Odstranění: tetra-n-butylamoniumfluorid
Ochrana hydroxylové skupiny v 3.4 umožnila vstup ketonu do Shapirovy reakce bvytvářející viyllithnou sloučeninu 3.7.
TES (triethylsilyl) [1]
Navázání: Triethylsilylchlorid a pyridin
Odstranění: hydrolýza kyselinou fluorovodíkovou, pyridinem a tetrahydrofuranem
Protection of the secondary hydroxyl group in 5.7 was necessary for the final addition of the tail to alcohol 7.2.
TES (triethylsilyl) [2]
Navázání: tvorba Odžimova laktamu
Odštěpení: Hydrolýza kyselinou fluorovodíkovou a pyridin
Chráněná je sekundární alkoholová skupina Odžimova laktamu 7.1 během reakce s alkoholem 7.2 při navazování vedlejšího řetězce.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Nicolaou Taxol total synthesis na anglické Wikipedii.
- Classics in Total Synthesis: Targets, Strategies, Methods K. C. Nicolaou, E. J. Sorensen ISBN 3-527-29231-4
- NICOLAOU, K. C.; YANG, Z.; LIU, J. J.; UENO, H.; NANTERMET, P. G.; GUY, R. K.; CLAIBORNE, C. F. Total synthesis of taxol. Nature. February 1994, s. 630–634. DOI 10.1038/367630a0. PMID 7906395. Bibcode 1994Natur.367..630N. (anglicky)
- K. C. Nicolaou; P. G. NANTERMET; H. UENO; R. K. GUY; E. A. COULADOUROS; E. J. SORENSEN. Total Synthesis of Taxol. 1. Retrosynthesis, Degradation, and Reconstitution. Journal of the American Chemical Society. 1995, s. 624–633. Dostupné online. DOI 10.1021/ja00107a006. (anglicky)
- K. C. Nicolaou; J.-J. LIU; Z. YANG; H. UENO; E. J. SORENSEN; C. F. CLAIBORNE; R. K. GUY. Total Synthesis of taxol. 2. Construction of A and C ring intermediates and initial attempts to construct the ABC ring system. Journal of the American Chemical Society. 1995, s. 634–644. DOI 10.1021/ja00107a007. (anglicky)
- K. C. Nicolaou; Z. YANG; J.-J. LIU; P. G. NANTERMET; C. F. CLAIBORNE; J. RENAUD; R. K. GUY. Total Synthesis of Taxol. 3. Formation of Taxol's ABC Ring Skeleton. Journal of the American Chemical Society. 1995, s. 645–652. DOI 10.1021/ja00107a008. (anglicky)
- K. C. Nicolaou; H. UENO; J.-J. LIU; P. G. NANTERMET; Z. YANG; J. RENAUD; K. PAULVANNAN. Total Synthesis of Taxol. 4. The Final Stages and Completion of the Synthesis. Journal of the American Chemical Society. 1995, s. 653–659. DOI 10.1021/ja00107a009. (anglicky)