Imidazol
Imidazol je dusíkatá aromatická heterocyklická sloučenina, klasifikována jako alkaloid. Imidazol je bílá nebo průhledná látka, která je rozpustná ve vodě, ve které vytváří mírně zásaditý roztok. Imidazol je základní sloučenina, ze které je odvozena třída sloučenin nazývaných imidazoly; tyto sloučeniny mají stejnou základní kruhovou strukturu, liší se však substituenty. Kruhový systém imidazolu je součástí důležitých biologických stavebních bloků, například aminokyseliny histidinu a příbuzného hormonu histaminu. Imidazol může sloužit jako zásada nebo slabá kyselina. Imidazolový kruh je obsažen v řadě léčiv, například antimykotikách a v nitroimidazolu.[3][4][5][6][7]
| Imidazol | |
|---|---|
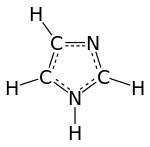
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | 1H-imidazol |
| Triviální název | glyoxalin |
| Ostatní názvy | 1,3-diazol, 1,3-diazacyklopenta-2,4-dien |
| Sumární vzorec | C3H4N2 |
| Identifikace | |
| Registrační číslo CAS | 288-32-4 |
| Vlastnosti | |
| Molární hmotnost | 68,077 g/mol |
| Disociační konstanta pKa | 14,5 (pro imidazol), 7,05 (pro konjugovanou kyselinu)[1] |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Název sloučeniny vymyslel německý chemik Arthur Rudolf Hantzsch (1857–1935).[8]
Struktury a vlastnosti
Imidazol je 5členný planární (rovinný) kruh, který existuje ve dvou ekvivalentních tautomerních formách, jelikož jeden vodík může být navázán na jeden nebo druhý atom dusíku. Elektrický dipólový moment imidazolu, jehož hodnota je 3,67D, svědčí o tom, že se jedná o vysoce polární sloučeninu. [9]
Sloučenina je charakterizována jako aromatická, díky přítomnosti planárního kruhu, který obsahuje 6 π-elektronů.
Amfoterita[10]
Imidazol je amfoterní, což znamená, že může fungovat jako báze i jako kyselina. Jako báze je pKa konjugované kyseliny přibližně 7, což činí imidazol přibližně šedesátkrát zásaditějším než pyridin. Hlavním místem je dusík s osamoceným párem, který není navázaný na vodík. Přidáním vodíkového protonu (protonací) vzniká symetrický imidazoliový kation. Jako kyselina imidazol pKa 14,5, což znamená, že je méně kyselý než karboxylové kyseliny, imidy i fenoly, ale zároveň o něco kyselejší než alkoholy. Kyselý proton je ten, který se váže na dusík. Deprotonací (odstranění vodíkového protonu z molekuly) vzniká imidazoliový anion, který je symetrický.
Příprava
Imidazol byl poprvé popsán v roce 1858 německým chemikem Heinrichem Debusem, ačkoli různé deriváty imidazolu byly objeveny již ve 40. letech 19. století. Prokázalo se, že glyoxal, formaldehyd a amoniak kondenzují (ze dvou výchozích organických molekul vzniká jedna větší molekula) za vzniku imidazolu.[11] Tato syntéza, i když poskytuje relativně nízké výtěžky, se stále používá pro generování C-substituovaných imidazolů.
Imidazol může být syntetizován řadou metod kromě Debusovy metody (organická reakce používaná pro syntézu imidazolů z dikarbonylu, aldehydu a amoniaku). Mnohé z těchto syntéz lze také aplikovat na substituované imidazoly tím, že změníme funkční skupiny na reakčních složkách. Tyto metody jsou běžně kategorizovány podle počtu reagujících složek.
Jedna reagující složka
Vazba (1,5) nebo (3,4) může být vytvořena reakcí imidátu a α-aminoaldehydu nebo α-aminoacetalu.
Dvě reagující složky
Vazby (1,2) a (2,3) mohou být vytvořeny reakcí 1,2-diaminoalkanu při vysokých teplotách s alkoholem, aldehydem nebo karboxylovou kyselinou. Je potřeba, aby byl přítomen dehydrogenační katalyzátor, jako je platina na oxidu hlinitém.
Dále mohou být vazby (1,2) a (3,4) vytvořeny z N-substituovaných α-aminoketonů a formamidu za přítomnosti tepla. Výsledným produktem bude bude 1,4-disubstituovaný imidazol, ale jelikož zde máme R1 = R2 = H (vodík) tak produktem bude samotný imidazol. Výtěžek této reakce je malý, ale zdá se, že je to nejúčinnější způsob substituce 1,4.
Tři reagující složky
Tato metoda probíhá za výsledku dobrých výtěžků pro substituované imidazoly. Adaptace Debusovy metody se nazývá syntéza Debus-Radziszewského imidazolu. Výchozími materiály je substituovaný glyoxal, aldehyd, amin a amoniak nebo sůl amonná.[12]
Výroba imidazolu z heterocyklů
Imidazol může být syntetizován fotolýzou 1-vinyltetrazolu. Tato reakce poskytne podstatné výtěžky pouze tehdy, je-li 1-vinyltetrazol vyroben z organo-cíničité sloučeniny, jako je 2-tributylstannyltetrazol.
Imidazol lze také vytvořit reakcí v parní fázi. Tato reakce probíhá s formamidem, ethylendiaminem a vodíkem nad platinou na oxidu hlinitém. Je potřeba, aby reakce probíhala mezi 340°C a 480°C. Díky tomu se vytvoří velmi čistý imidazolový produkt.
Van Leusenova syntéza
Van Leusenova reakce může být také použita k vytvoření imidazolů vycházejících z tosylmethylisokyanidem (TosMIC - CH₃C₃H₄SO₂CH₂NC.) a aldiminu. Syntéza byla později rozšířena na dvoukrokovou reakci.
Biologické využití a aplikace
Imidazol je součástí mnoha důležitých biologických sloučenin. Nejrozšířenější je aminokyselina histidin, která má imidazolový postranní řetězec. Histidin je přítomen v mnoha proteinech a enzymech a hraje důležitou roli ve struktuře a vazebných funkcích hemoglobinu. Histidinové sloučeniny založené na imidazolové bázi mají významnou roli v intracelulárním (nitrobuněčném) pufrování[13]. Histidin může být dekarboxylován na histamin, což je také běžná biologická sloučenina. Histamin může způsobit kožní onemocnění kopřivku pokud je produkován během alergické reakce.
Jednou z aplikací imidazolu je purifikace tzv. His-značených proteinů (His-značení neboli polyhistidinová značka je řetězec histidinových zbytků na N- nebo C- konci rekombinantního proteinu[14]) v afinitivní chromatografii s imobilizovaným kovem (IMAC). Imidazol se používá k eluci (vylouhování) značených proteinů vázaných na ionty niklu připojené k povrchu kuliček v chromatografickému sloupci. Sloupcem prochází nadbytek imidazolu, který vytěsňuje His-značení (His-tag) z koordinace niklu, čímž se uvolňují His-značené proteiny.
Farmaceutické deriváty
Imidazol se stal důležitou součástí mnoha léčiv. Syntetické imidazoly jsou přítomny v mnoha fungicidech a antifungálních (působící proti houbám), antiprotozoálních (antivirových) lécích. Je zároveň součástí molekuly teofylinu, která se nachází v čajových listech, kávových zrnech a stimuluje centrální nervový systém. Je přítomen v protirakovinném léku merkaptopurin, který bojuje proti leukémii tím, že zasahuje do aktivit DNA.
Řada substituovaných imidazolů, včetně klotrimazolu, jsou selektivními inhibitory syntézy oxidu dusnatého, což z nich činí zajímavé cíle pro nové léky proti zánětům, neurodegenerativním onemocněním a nádorům nervového systému[15][16].
Využití při biologickém výzkumu
Imidazol je vhodný pufr neboli tlumivý roztok pro pH 6.2 - 7.8[17]. Čistý imidazol bez příměsí nemá v podstatě žádnou absorbanci na vlnových délkách relevantních pro protein (280nm)[18][19], avšak nižší hodnoty stoprocentního imidazolu mohou poskytnout výraznou absorbanci při 280 nm. Imidazol může interferovat s Lowryho proteinovým testem[20]. Lowryho proteinový test je biochemický test určený ke stanovení hladiny proteinu v roztoku.[21]
Průmyslové využití
Samotný imidazol má málo přímých aplikací, ale je prekurzorem různých agrochemikálií mezi které patří enilkonazol, klotrimazol, prochloraz, bifonazol a klimbazol.[22]
Soli imidazolu
Soli imidazolu, kde je kationtem imidazolový kruh, jsou známé jako imidazoliové soli (například imidazoliový chlorid nebo dusičnan).[23] Tyto soli se tvoří substitucí na dusíku imidazolu nebo protonací. Soli imidazolu byly použity jako iontové kapaliny a prekurzory stabilních karbenů. Soli, kde je deprotonovaný imidazol anion, jsou také známé jako imidazoláty.
Reference
V tomto článku byl použit překlad textu z článku Imidazole na anglické Wikipedii.
- WALBA, HAROLD; ISENSEE, ROBERT W. Acidity Constants of Some Arylimidazoles and Their Cations. The Journal of Organic Chemistry. Roč. 26, čís. 8, s. 2789–2791. Dostupné online. DOI 10.1021/jo01066a039.
- Imidazole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Alan R. Katritzky; Rees. Comprehensive Heterocyclic Chemistry. Vol. 5, p.469-498, (1984).
- Grimmett, M. Ross. Imidazole and Benzimidazole Synthesis. Academic Press, (1997).
- Brown, E.G. Ring Nitrogen and Key Biomolecules. Kluwer Academic Press, (1998).
- Pozharskii, A.F, et al. Heterocycles in Life and Society. John Wiley & Sons, (1997).
- Heterocyclic Chemistry TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- HANTZSCH, A.; WEBER, J. H. Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe). Berichte der deutschen chemischen Gesellschaft. 1887-07, roč. 20, čís. 2, s. 3118–3132. Dostupné online [cit. 2022-01-27]. ISSN 0365-9496. DOI 10.1002/cber.188702002200.
- Christen, Dines; Griffiths, John H.; Sheridan, John (1981). "The Microwave Spectrum of Imidazole; Complete Structure and the Electron Distribution from Nuclear Quadrupole Coupling Tensors and Dipole Moment Orientation". Zeitschrift für Naturforschung A. 36 (12): 1378–1385. Bibcode:1981ZNatA..36.1378C. doi:10.1515/zna-1981-1220. S2CID 3522351.
- Amfoterita. [s.l.]: [s.n.] Dostupné online. (česky) Page Version ID: 20285169.
- From p. 205: "Die gereinigte Substanz stellt das oxalsaure Salz einer Basis dar, die ich mit Glyoxalin bezeichenen werde." (The purified substance constitutes the oxalic salt of a base, which I will designate as "glyoxaline".)
- US patent 6,177,575, Arduengo, A. J., "Process for Manufacture of Imidazoles", issued 2001-01-23
- Hochachka, P. W.; Somero, G. N. (2002). Biochemical Adaptation: Mechanisms and Process in Physiological Evolution. New York: Oxford University Press.
- NTA agaróza pro His-značené rekombinantní proteiny. www.carolinabiosystems.cz [online]. [cit. 2022-01-31]. Dostupné online.
- Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, N. E.; Gil, C. (2008). "Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase" (PDF). Bioorg. Med. Chem. (Submitted manuscript). 16 (11): 6193–6206. doi:10.1016/j.bmc.2008.04.036. hdl:10261/87090. PMID 18477512.
- Bogle, R. G.; Whitley, G. S.; Soo, S. C.; Johnstone, A. P.; Vallance, P. (1994). "Effect of anti-fungal imidazoles on mRNA levels and enzyme activity of inducible nitric oxide synthase". Br. J. Pharmacol. 111 (4): 1257–1261. doi:10.1111/j.1476-5381.1994.tb14881.x. PMC 1910171. PMID 7518297.
- Dawson, R. M. C. (1986). Data for biochemical research. Oxford: Clarendon Press. p. 325. ISBN 978-0-19-855299-4. OCLC 11865673.
- "1H-Imidazole". Retrieved 13 May 2021
- "Optimizing Purification of Histidine-Tagged Proteins". Retrieved 13 May 2021.
- Molina, F; Rueda, A; Bosque-Sendra, J.M; Megias, L (1996). "Determination of proteins in the presence of imidazole buffers". Journal of Pharmaceutical and Biomedical Analysis. Elsevier BV. 14 (3): 273–280. doi:10.1016/0731-7085(95)01615-5. ISSN 0731-7085. PMID 8851751.
- Van Noorden, R.; Maher, B.; Nuzzo, R. (2014). "The top 100 papers". Nature. 514 (7524): 550–553. Bibcode:2014Natur.514..550V. doi:10.1038/514550a. PMID 25355343.
- Ebel, K., Koehler, H., Gamer, A. O., & Jäckh, R. (2002). "Imidazole and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_661.
- Zolfigol, Mohammad A.; Khazaei, Ardeshir; Moosavi-Zare, Ahmad R.; Zare, Abdolkarim; Kruger, Hendrik G.; Asgari, Zhila; Khakyzadeh, Vahid; Kazem-Rostami, Masoud (2012-04-06). "Design of Ionic Liquid 3-Methyl-1-sulfonic Acid Imidazolium Nitrate as Reagent for the Nitration of Aromatic Compounds by in Situ Generation of NO2 in Acidic Media". The Journal of Organic Chemistry. 77 (7): 3640–3645. doi:10.1021/jo300137w. ISSN 0022-3263. PMID 22409592.


