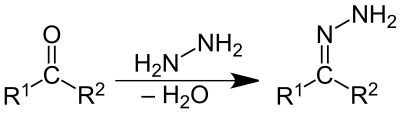
Hydrazony
Hydrazony jsou skupina organických sloučenin s obecným strukturním vzorcem R1R2C=N-NH2. Lze je odvodit od aldehydů a ketonů nahrazením kyslíkového atomu skupinou N-NH2.
Příprava a výroba
Hydrazony se obvykle připravují reakcí hydrazinu s aldehydem či ketonem.[1][2] Rovněž je lze získat Jappovou–Klingemannovou reakcí, tedy reakcí β ketokyselin či β ketoesterů s aryldiazoniovými solemi. V minulosti byl k výrobě farmaceuticky zajímavých hydrazonů fenolu používán zvláštní mechanochemický proces.[3]
Vlastnosti
Ve vodném roztoku jsou hydrazony k hydrolýze stokrát až tisíckrát náchylnější než odpovídající oximy.[4]
Reakce
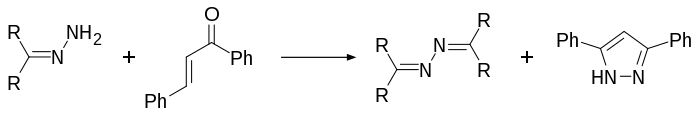
Hydrazony se mohou účastnit mnoha různých reakcí, jako jsou například hydrazonová jodace, Shapirova reakce a Bamfordova–Stevensova reakce, při nichž vznikají vinylové sloučeniny, a jsou též meziprodukty Wolffovy–Kishnerovy redukce. Při přípravě 3,5-disubstituovaných 1H-pyrazolů se hydrazony přeměňují na aziny[5] (při této reakci se rovněž používá hydrát hydrazinu).[6]
N,N'-dialkylhydrazony
U N,N'-dialkylhydrazonů[7] může proběhnout hydrolýza, oxidace i redukce vazby C=N a vazbu N-N lze zredukovat na volný amin.Uhlíkový atom vazby C=N může reagovat s organokovovými nukleofily. Alfa vodík je o 10 řádů kyselejší, a tedy i nukleofilnější, než keton. Deprotonací, provedenou například diisopropylamidem lithným, vzniká azaenolát, který je možné alkylovat alkylhalogenidy, tuto reakci objevili Elias James Corey a Dieter Enders roku 1978.[8][9] Při asymetrické syntéze látek SAMP a RAMP se využívají dva chirální hydraziny, které fungují jako chirální pomocníci, přičemž se vytváří meziprodukt v podobě chirálního hydrazonu.[10][11][12]
Použití
Tvorba aromatických hydrazonových derivátů se využívá k určení koncentrace aldehydů a ketonů s nízkou molekulární hmotností v proudech plynů; jako příklad lze uvést dinitrofenylhydrazin nanesený na vrstvu oxidu křemičitého, jenž slouží jako adsorbční vrstva. Hydrazony se následně vymyjí a analyzují pomocí vysokoúčinné kapalinové chromatografie s využitím ultrafialového detektoru.
Při syntéze adenosintrifosfátu (ATP) a redukci kyslíku při oxidační fosforylaci v molekulární biologii.
Galerie
- Hydrazony
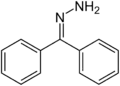 Benzofenon hydrazon, příklad hydrazonu
Benzofenon hydrazon, příklad hydrazonu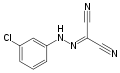 Karbonylkyanid m-chlorfenyl hydrazon
Karbonylkyanid m-chlorfenyl hydrazon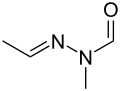 Gyromitrin (acetaldehyd methylformylhydrazon), mykotoxin
Gyromitrin (acetaldehyd methylformylhydrazon), mykotoxin Dihydralazin, léčivo proti vysokému krevnímu tlaku
Dihydralazin, léčivo proti vysokému krevnímu tlaku
Reference
V tomto článku byl použit překlad textu z článku Hydrazone na anglické Wikipedii.
- STORK, G.; BENAIM, J. Monoalkylation of α,β-Unsaturated Ketones via Metalloenamines: 1-butyl-10-methyl-Δ1(9)-2-octalone. Org. Synth.. 1977, s. 69. Dostupné online. (anglicky); Coll. Vol.. S. 242. (anglicky)
- DAY, A. C.; WHITING, M. C. Acetone hydrazone. Org. Synth.. 1970, s. 3. Dostupné online. (anglicky); Coll. Vol.. S. 10. (anglicky)
- OLIVEIRA, P. F. M.; BARON, M.; CHAMAYOU, A.; ANDRÉ-BARRÈS, C.; GUIDETTI, B.; BALTAS, M. Solvent-free mechanochemical route for green synthesis of pharmaceutically attractive phenol-hydrazones. RSC Adv.. 2014, s. 56736–56742. DOI 10.1039/c4ra10489g. (anglicky)
- KALIA, J.; RAINES, R. T. Hydrolytic stability of hydrazones and oximes. Angew. Chem. Int. Ed.. 2008, s. 7523–6. DOI 10.1002/anie.200802651. PMID 18712739. (anglicky)
- LASRI, Jamal; ISMAIL, Ali I. Metal-free and FeCl3-catalyzed synthesis of azines and 3,5-diphenyl-1H-pyrazole from hydrazones and/or ketones monitored by high resolution ESI+-MS. Indian Journal of Chemistry - Section B. 2018, s. 362-373. Dostupné online. (anglicky)
- ZHANG, Ze; TAN, Ya-Jun; WANG, Chun-Shan; WU, Hao-Hao. One-pot synthesis of 3,5-diphenyl-1H-pyrazoles from chalcones and hydrazine under mechanochemical ball milling. Heterocycles. 2014, s. 103-112. DOI 10.3987/COM-13-12867. (anglicky)
- LAZNY, R.; NODZEWSKA, A. N,N-dialkylhydrazones in organic synthesis. From simple N,N-dimethylhydrazones to supported chiral auxiliaries. Chemical Reviews. 2010, s. 1386–1434. DOI 10.1021/cr900067y. PMID 20000672. (anglicky)
- COREY, Elias James; ENDERS, D. Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C_C bond formation; oxidative hydrolysis to carbonyl compounds. Tetrahedron Letters. 1976, s. 3–3. DOI 10.1016/S0040-4039(00)71307-4. (anglicky)
- COREY, E. J.; ENDERS, D. Herstellung und synthetische Verwendung von metallierten Dimethylhydrazonen Regio- und stereoselektive Alkylierung von Carbonylverbindungen. Chemische Berichte. 1978, s. 1337–1361. DOI 10.1002/cber.19781110413. (anglicky)
- ENDERS, D.; EICHENAUER, H. Enantioselective alkylation of aldehydes via metalated chiral hydrazones. Tetrahedron Letters. 1977, s. 191–194. DOI 10.1016/S0040-4039(01)92585-7. (anglicky)
- ENDERS, Dieter; FEY, Peter; KIPPHARDT, Helmut. (S)-(−)-1-Amino-2-methoxymethylpyrrolidine (SAMP) and (R)-(+)-1-amino-2-methoxymethylpyrrolidine (RAMP), versatile chiral auxiliaries. Org. Synth.. 1987, s. 173. Dostupné online. (anglicky); Coll. Vol.. S. 26. (anglicky)
- ENDERS, Dieter; KIPPHARDT, Helmut; FEY, Peter. Asymmetric syntheses using the SAMP-/RAMP-hydrazone method: (S)-(+)-4-methyl-3-heptanone. Org. Synth.. 1987, s. 183. Dostupné online. (anglicky); Coll. Vol.. S. 403. (anglicky)