Wielandův–Miescherův keton
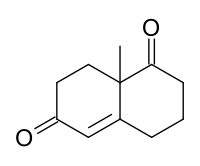
Wielandův–Miescherův keton (WMK) je organická sloučenina[1], racemický bicyklický diketon, a všestranná surovina pro organickou syntézu; používá se k přípravě a výrobě více než 50 látek, hlavně seskviterpenoidů, diterpenů a steroidů, které mají antimikrobiotické, antivirotické, imunomodulační nebo i jiné účinky. Látka je pojmenována po chemicích Karlu Miescherovi a Peteru Wielandovi. Příklady syntéz prováděných za použití tohoto diketonu jako výchozího materiálu jsou výroba ancistrofuranu[2] a taxolu.[3]
| Wielandův–Miescherův keton | |
|---|---|
Strukturní vzorec | |
| Obecné | |
| Systematický název | 8a-methyl-3,4,8,8a-tetrahydronaftalen-1,6(2H,7H)-dion |
| Anglický název | Wieland–Miescher ketone |
| Německý název | Wieland-Miescher Keton |
| Sumární vzorec | C11H14O2 |
| Identifikace | |
| Registrační číslo CAS | 20007-72-1 |
| PubChem | 89262 |
| SMILES | CC12CCC(=O)C=C1CCCC2=O |
| InChI | 1/C11H14O2/c1-11-6-5-9(12)7-8(11)3-2-4-10(11)13/h7H,2-6H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 178,228 g/mol |
| Teplota tání | 47–50 °C (320–323 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
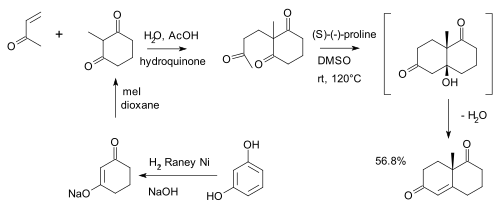
Původní Wielandův–Miescherův keton je racemický a získává se Robinsonovou anelací 2-methylcyklohexan-1,3-dionu a methylvinylketonu. Alkohol vznikající jako meziprodukt nebyl izolován. 2-methylcyklohexan-1,3-dion lze připravit z resorcinolu[4] hydrogenací na dihydroresorcinol (ve formě enolátu) za použití Raneyova niklu následovanou alkylací methyljodidem.
Enantioselektivní syntéza WMK využívá L-prolin jako organický katalyzátor[5]:
Byly také zkoumány další katalyzátory založené na prolinu.[6]
Reference
V tomto článku byl použit překlad textu z článku Wieland–Miescher ketone na anglické Wikipedii.
- Wieland, P.; Miescher, K. Über die Herstellung mehrkerniger Ketone., Helv. Chim. Acta 1950, 33, 2215
- Ciceri, Paola, Demnitz, F.W. Joachim, Souza, Márcia C.F. de, Lehmanna, Maik. A Common Approach to the Synthesis of Monocyclofarnesyl Sesquiterpenes. J. Braz. Chem. Soc. 1998, 9, 409-414. ISSN 0103-5053. (Article)
- Samuel J. Danishefsky, John J. Masters, Wendy B. Young, J. T. Link, Lawrence B. Snyder, Thomas V. Magee, David K. Jung, Richard C. A. Isaacs, William G. Bornmann, Cheryl A. Alaimo, Craig A. Coburn, and Martin J. Di Grandi (1996). "Total Synthesis of Baccatin III and Taxol". J. Am. Chem. Soc. 118 (12): 2843-2859. DOI:10.1021/ja952692a
- A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman Organic Syntheses, Coll. Vol. 5, p.743 (1973); Vol. 41, p.56 (1961). (Article Archivováno 28. 7. 2012 na Wayback Machine)
- 1,6(2H, 7H)-Naphthalenedione, 3,4,8,8a-tetrahydro-8a-methyl-, (S)- Paul Buchschacher, A. Fürst, and J. Gutzwiller Organic Syntheses, Coll. Vol. 7, p.368 (1990); Vol. 63, p.37 (1985). (Article Archivováno 28. 7. 2012 na Wayback Machine)
- Org. Synth. 2011, 88, 330-341 Link
Externí odkazy
 Obrázky, zvuky či videa k tématu Wielandův–Miescherův keton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Wielandův–Miescherův keton na Wikimedia Commons