Estery kyseliny uhličité
Estery kyseliny uhličité, také nazývané karbonáty nebo organouhličitany jsou estery odvozené od kyseliny uhličité. Jejich molekuly obsahují karbonylovou skupinu spojenou s dvěma alkoxyskupinami. Obecný vzorec těchto sloučenin je R1O(C=O)OR2; jsou podobné esterům karboxylových kyselin R1O(C=O)R, etherům R1OR2 a také anorganickým uhličitanům.
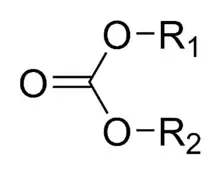
Monomery polykarbonátů se do polymerních řetězců spojují přes karbonátové skupiny. Polykarbonáty se používají na výrobu kompaktních disků, neprůstřelného skla a čoček brýlí. Nižší uhličitanové estery, například dimethylkarbonát, ethylenkarbonát a propylenkarbonát, se používají jako rozpouštědla, dimethylkarbonát také jako alkylační činidlo.
Struktura
Molekuly uhličitanových esterů obsahují rovinné skupiny OC(OC)2. Vazby C=O jsou poměrně krátké (ve výše uvedeném příkladě mají délku 117,3 pm), zatímco vazby C-O jsou o něco delší (v uvedeném příkladě mají délku 132,6 pm).[1]
Podle struktury hlavního řetězce lze uhličitanové estery rozdělit do tří skupin, na acyklické, cyklické a polymerní; nejčastěji se vyskytují acyklické organouhličitany. Jsou známy uhličitanové estery s aromatickými i alifatickými substituenty.
Uhličitanové skupiny mohou být propojeny můstky tvořenými dvěma nebo třemi atomy uhlíku v cyklické molekuly, jako je ethylenkarbonát a trimethylenkarbonát. Na uhlíkový můstek mohou být navázány substituenty, například CH3 u propylenkarbonátu. Koncová alkylová nebo arylová skupina může být propojena s jinou rovněž alifatickou či aromatickou bifunkční skupinou.
Existují také polymerní karbonáty, například poly(propylenkarbonát) a poly(bisfenol A-karbonát).
Výroba a příprava
Organouhličitany se nezískávají z anorganických uhličitanů.
Jedním ze způsobů výroby je reakce alkoholu nebo fenolu s fosgenem (fosgenace), druhým reakce s oxidem uhelnatým za přítomnosti oxidačního činidla (oxidační karbonylace). Některé estery kyseliny uhličité se připravují transesterifikací.[2]
Teoreticky by bylo možné získávat estery kyseliny uhličité reakcí alkoholu s oxidem uhličitým, tento postup je ovšem termodynamicky nevýhodný.[3]
K odstraňování vody z reakční směsi a navýšení výnosnosti lze použít selektivní membránu.[4][5][6][7]
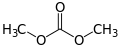 Dimethyllarbonát, příklad acyklického esteru kyseliny uhličité
Dimethyllarbonát, příklad acyklického esteru kyseliny uhličité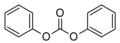 Difenylkarbonát, další acyklický karbonát
Difenylkarbonát, další acyklický karbonát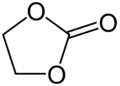 Ethylenekarbonát, cyklický karbonát
Ethylenekarbonát, cyklický karbonát Trimethylenkarbonát, další cyklický karbonát
Trimethylenkarbonát, další cyklický karbonát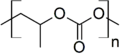 Poly(propylenkarbonát)
Poly(propylenkarbonát)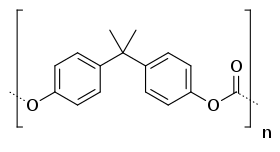 Poly(bisfenol A-karbonát)]
Poly(bisfenol A-karbonát)]
Fosgenace
Alkoholy a fenoly reagují s fosgenem za vzniku esterů kyseliny uhličité podle následující obecné rovnice:
2 ROH + COCl2 → RO(CO)OR + 2 HCl
Reakce má vysokou výtěžnost; tímto způsobem se vyrábějí polykarbonáty odvozené od bisfenolu A. Používá se však při ní jedovatý fosgen a k neutralizaci vznikající kyseliny chlorovodíkové jsou nutná stechiometrická množství zásad (například pyridinu).[2] Meziprodukty zde jsou chlormravenčany, které se místo reakce s dalším ekvivalentem alkoholu disproporcionují, přičemž se tvoří požadované estery.
- C6H5OH + COCl2 → C6H5O(CO)Cl + HCl
- 2 C6H5O(CO)Cl → C6H5O(CO)OC6H5 + COCl2
Souhrnná rovnice reakce vypadá takto:
- 2 C6H5OH + COCl2 → C6H5O(CO)OC6H5 + 2 HCl
Oxidační karbonylace
Dalčí možností výroby esterů kyseliny uhličité je oxidační karbonylace. Její výhodou je, že není třeba používat fosgen. Reakce probíhá za přítomnosti katalyzátorů obsahujících měď; například dimethylkarbonát zde vzniká podle této rovnice:
- 4 CH3OH + CO + O2 → 2 CH3O(CO)OCH3 + 2 H2O
Podobně, ovšem s použitím palladnatých katalyzátorů, se také vyrábí difenylkarbonát. Při reakci je nutné použít kokatalyzátor, který zpětně zoxiduje palladium zredukované z oxidačního čísla 0 na II. Při průmyslové výrobě je katalyzátorem acetylacetonát manganitý.[8]
Reakce oxidu uhelnatého s epoxidy
Reakcí oxidu uhelnatého s epoxidy se vyrábí karbonáty obsahující pětičlenné cykly. V roce 2010 se takto vyrobilo kolem 100 000 tun cyklických karbonátů.[9] Reakcemi ethylenoxidu a propylenoxidu s oxidem uhličitým za použití vhodného katalyzátoru se poměrně snadno tvoří příslušné ethylen- a propylenkarbonáty.[2]
- C2H4O + CO2 → C2H4O2CO
Bylo zkoumáno několik katalyzátorů takových reakcí, stejně jako možnosti přípravy cyklických karbonátů bez použití epoxidů.[9]
Transesterifikace
Estery kyseliny uhličité lze přeměnit na jiné transesterifikací. Nukleofilnější alkohol přitom v molekule esteru nahrazuje méně nukleofilní, například alifatické alkoholy způsobují vytěsnění fenolů. Pokud je odcházející alkohol těkavý, tak lze rovnováhu reakce posunout destilací.[2]
Použití
Estery kyseliny uhličité se používají jako polární rozpouštědla,[11] která zůstávají kapalná ve velkém rozsahu teplot, například propylenkarbonát taje při −55 °C a vře při 240 °C. Dalšími výhodami jsou nízká toxicita pro životní prostředí a dobrá biologická rozložitelnost.[12]
Estery kyseliny uhličité se jako rozpouštědla používají například v lithium-iontových akumulátorech, kde díky své značné polaritě rozpouštějí lithné soli. Vysokou viskozitu lze vyřešit například použitím směsi dimethylkarbonátu, diethylkarbonátu a dimethoxyethanu.
Cyklické karbonáty lze použít na výrobu polymerů.
Reference
V tomto článku byl použit překlad textu z článku Carbonate ester na anglické Wikipedii.
- Serge Perez; Raymond P. Scaringe. Crystalline features of 4,4'-isopropylidenediphenylbis(phenyl carbonate) and conformational analysis of the polycarbonate of 2,2-bis(4-hydroxyphenyl)propane. Macromolecules. 1987, s. 68–77. DOI 10.1021/ma00167a014. Bibcode 1987MaMol..20...68P.
- Abbas-Alli G. Shaikh; Swaminathan Sivaram. Organic Carbonates. Chemical Reviews. 1996, s. 951–976. DOI 10.1021/cr950067i. PMID 11848777.
- Zhi-Fang Zhang. Synthesis of Dimethyl Carbonate from Carbon Dioxide and Methanol over CexZr1-xO2and [EMIM]Br/Ce0.5Zr0.5O2. Industrial & Engineering Chemistry Research. 2011, s. 1981–1988. DOI 10.1021/ie102017j.
- Chuan-Feng Li. Study on application of membrane reactor in direct synthesis DMC from CO2 and CH3OH over Cu–KF/MgSiO catalyst. Catalysis Today. 2003, s. 83–90. DOI 10.1016/S0920-5861(03)00205-0.
- http://alexandria.tue.nl/extra1/afstversl/st/vermerris2005.pdf
- Ahmed Aouissi; Zeid Abdullah Al-Othman; Amro Al-Amro. Gas-Phase Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide over Co1.5PW12O40 Keggin-Type Heteropolyanion. International Journal of Molecular Sciences. 2010, s. 1343–1351. DOI 10.3390/ijms11041343. PMID 20480023.
- Jun Bian. Highly effective synthesis of dimethyl carbonate from methanol and carbon dioxide using a novel copper–nickel/graphite bimetallic nanocomposite catalyst. Chemical Engineering Journal. 2009, s. 287–296. DOI 10.1016/j.cej.2008.11.006. PMID 20480023.
- Grigorii L. Soloveichik. Liquid Phase Aerobic Oxidation Catalysis: Industrial Applications and Academic Perspectives: Industrial Applications and Academic Perspectives. Příprava vydání Shannon S. Stahl, Paul L. Alsters. [s.l.]: Wiley-VCH, 2016. ISBN 9783527337811. DOI 10.1002/9783527690121.ch12. Kapitola Oxidative Carbonylation: Diphenyl Carbonate, s. 189–208.
- Michael North; Riccardo Pasquale; Carl Young. Synthesis of cyclic carbonates from epoxides and CO2. Green Chemistry. 2010, s. 1514. DOI 10.1039/c0gc00065e.
- [cit. 2013-10-04]. Dostupné v archivu pořízeném z originálu dne 2013-10-05.
- B. Schäffner; F. Schäffner; S. P. Verevkin; A. Börner. Organic Carbonates as Solvents in Synthesis and Catalysis. Chemical Reviews. 2010, s. 4554–4581. DOI 10.1021/cr900393d. PMID 20345182.
- Sibiya, Mike Sbonelo. Catalytic transformation of propylene carbonate into dimethyl carbonate and propylene glycol
Externí odkazy
 Obrázky, zvuky či videa k tématu Estery kyseliny uhličité na Wikimedia Commons
Obrázky, zvuky či videa k tématu Estery kyseliny uhličité na Wikimedia Commons