Nukleofilní adice
Nukleofilní adice je nejčastější reakce karbonylových sloučenin. Kromě karbonylových sloučenin může probíhat i u nitrilů (R-C≡N), iminů (R1-CH=N-R2) i alkenů.[1]
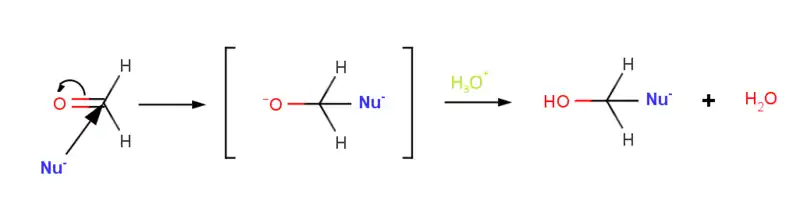
Mechanismus
Nukleofil Nu− postupuje podél vazby C=O pod úhlem asi 75 ° k rovině karbonylové skupiny a naváže se na elektrofilní uhlík C=O skupiny. Ve stejnou dobu dochází k rehybridizaci karbonylového uhlíku z sp2 na sp3, elektronový pár z vazby C=O přeskočí na elektronegativní kyslík a okamžitě vzniká čtyřstěnný alkoxidový iont. V kyselém prostředí se stabilizuje na konečný alkohol.[2]
Karbonylové sloučeniny
Jako nukleofil může být použit:
- Alkohol R-OH na přípravu poloacetalů při reakci s prvním ekvivalentem, při reakci s druhým ekvivalentem pro přípravu acetalů
- Aniont vodíku H− na redukci na alkohol
- Amin R-NH2 nebo imin R1-CH=N-R2 podle mechanismu Schiffovy reakce
- Karbonylová sloučenina s vodíky na α-uhlíku na aldolovou reakci
- Grignardovo činidlo na prodloužení řetězce
Nitrily
Nukleofilní adice na nitrily:
- Hydrolýza na amid až karboxylovou kyselinu
- Adice alkoholu podle mechanismu Pinnerovy reakce
- Karbonylová sloučenina nebo nitril s vodíky na α-uhlíku podle mechanismu Thorpovy reakce
Cramovo pravidlo
Při nukleofilní adici na karbonylové sloučeniny vzniká chirální centrum *. Za předpokladu, že R a R' nemají chirální vlastnosti, bude nukleofil výchozí, v podstatě planární molekulu, atakovat se stejnou pravděpodobností z obou stran. Vznikne tedy směs, která obsahuje stejné množství obou enantiomerů, tj racemát+-. Ale pokud původní karbonylová sloučenina již obsahuje chirální centrum - zejména pokud je chirální centrum v poloze α - atak z jedné strany karbonylového uhlíku už nebude (statisticky) stejně pravděpodobný jako z druhé strany. Výsledkem bude, že oba diastereoizomery nevzniknou ve stejných množstvích.[3]
Reference
V tomto článku byl použit překlad textu z článku Nukleofilná adícia na slovenské Wikipedii.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Nukleofilní adice na Wikimedia Commons
Obrázky, zvuky či videa k tématu Nukleofilní adice na Wikimedia Commons