Pinakolové párování
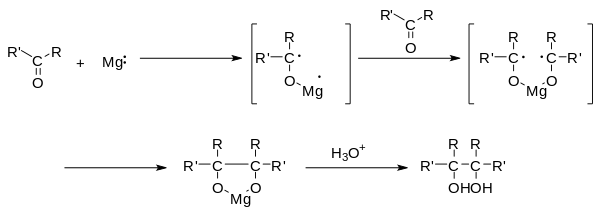
Pinakolové párování je organická reakce, při které se radikálově vytváří vazba uhlík–uhlík mezi karbonylovými skupinami aldehydu nebo ketonu za přítomnosti donoru elektronů.[1]
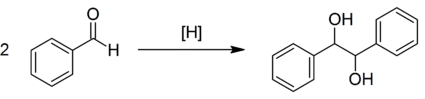
Produkty jsou vicinální dioly. Reakce je pojmenována po pinakolu (2,3-dimethyl-butan-2,3-diolu), který v ní vzniká při použití acetonu. Obvykle se jedná o homopárování, mohou však také probíhat vnitromolekulární křížová párování.
Pinakol objevil Wilhelm Rudolph Fittig v roce 1859.
Mechanismus
Prvním krokem mechanismu je jednoelektronová redukce karbonylové sloučeniny, kde jako redukční činidlo může sloužit například hořčík, na ketylový radikálový anion. Následně se spojí dvě ketylové skupiny za vzniku vicinálního diolu s deprotonovanými hydroxyly. Přidáním vody nebo jiného donoru protonů se tvoří diol. Při použití hořčíku je úvodním produktem pětičlenný cyklus s dvojicí atomů kyslíku koordinovaných na oxidovaný ion Mg2+. Tento komplex reaguje s dalším přídavkem vody a uvolní hydroxid hořečnatý. Poté může následovat pinakolový přesmyk.
Podobná je McMurryova reakce, u níž se používá chlorid titanitý nebo titaničitý ve spojení s redukčními činidly a vytvářejí se komplexy kovu s dioly, a objevuje se další deoxygenační krok, který zajišťuje vznik výsledného alkenu.
Možnosti
U benzofenonu může pinakolové párování proběhnout fotochemicky.[2] Benzaldehyd lze do této reakce zapojit za použití hliníku jako redukčního činidla a chloridu vanaditého jako katalyzátorů.[3] Při provádění této reakce po dobu 3 dnů ve vodě [za pokojové teploty bylo dosaženo 72% výtěžnosti a poměr dl:meso činil 56:44.
V dalším případě se u benzaldehydu podařilo s využitím montmorillonitu K-10 a chloridu zinečnatého ve směsi vody a tetrahydrofuranu (THF) za působení ultrazvuku zkrátit reakční čas na 3 hodiny, poměr dl:meso byl 55:45.[4]
Některé deriváty kyseliny vinné lze získat s vysokou diastereoselektivitou pomocí jodidu samarnatého a hexamethylfosforamidu (HMPA).[5]
Pinakolová párování nachází využití v totálních syntézách, jako jsou Mukaijamova a Nicolaouova totální syntéza taxolu.
p-Hydroxypropiofenon se používá jako substrát při syntéze diethylstilbestrolu.
Na přípravu fenaglykodolu bylo použito pinakolové párování para-chloracetofenonu s acetonem, dosažená výtěžnost činila 40 %.
Odkazy
Literatura
- ROGER ADAMS; E. W. ADAMS. Pinacol Hydrate. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 459. (anglicky)
Reference
V tomto článku byl použit překlad textu z článku Pinacol coupling reaction na anglické Wikipedii.
- R. Fittig. Ueber einige Producte der trockenen Destillation essigsaurer Salze. Justus Liebigs Annalen der Chemie. 1859, s. 23–45. Dostupné online. DOI 10.1002/jlac.18591100103.
- W. E. BACHMANN. Benzopinacol. Org. Synth.. 1943. Dostupné online. (anglicky); Coll. Vol.. S. 71. (anglicky)
- Xiaoliang Xu; Toshikazu Hirao. Vanadium-Catalyzed Pinacol Coupling Reaction in Water. The Journal of Organic Chemistry. 2005, s. 8594–8596. DOI 10.1021/jo051213f. PMID 16209617.
- Zang Hongjun; Li Jitai; Bian Yanjiang; Li Tongshuang. Pinacolization of aromatic aldehydes using Zn/montmorillonite K10-ZnCl2 in aqueous THF under ultrasound. Chemical Journal on Internet. 2003, s. 8. Dostupné online.
- Yong Hae Kim; Sam Min Kim; So Won Youn. Asymmetric synthesis by stereocontrol. Pure and Applied Chemistry. 2001, s. 283–286. DOI 10.1351/pac200173020283.