Silylether
Silylethery jsou organické sloučeniny, v jejichž molekulách se nachází atom křemíku, který je kovalentně vázán na alkoxyskupinu. Jejich obecný vzorec je R1R2R3Si−O−R4, kde R1 až R4 jsou alkylové nebo arylové, substituované či nesubstituované, skupiny. Silylethery se často používají v organické syntéze jako chránicí skupiny u alkoholů. Jelikož R1 až R4 mohou představovat nejrůznější kombinace funkčních skupin a vytvářet tím různé silylethery, tak nabízí tato skupina chemických sloučenin široké spektrum selektivity chránicích skupin. K běžným silyletherovým skupinám patří trimethylsilyl (TMS), terc-butyldifenylsilyl (TBDPS), terc-butyldimethylsilyl (TBS/TBDMS) a triisopropylsilyl (TIPS). Jsou obzvlášť výhodné, protože mohou být selektivně připojeny i odstraněny již za relativně mírných podmínek.
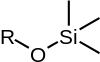
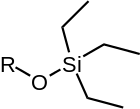
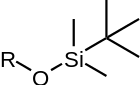
Běžné silylethery
 |
 |
 |
 |
 |
| TMS | TES | TBS/TBDMS | TBDPS | TIPS |
| Trimethylsilylether | Triethylsilylether | terc-butyldimethylsilylether | terc-butyldiphenylsilylether | Triisopropylsilylether |
Příprava
I když je k dispozici mnoho metod přípravy silyletherů, používají se pro silylaci alkoholů hlavně dvě z nich: reakce alkoholu se silylchloridem za použití aminu jako zásady při pokojové teplotě a reakce alkoholu se silyltriflátem za použití aminu při nízké teplotě. Silyltrifláty jsou reaktivnější než odpovídající chloridy, a lze je tak použít k připojení silylových skupin na místa pod vlivem sterických efektů. Velmi spolehlivým a rychlým způsobem je Coreyho reakce, kde alkohol reaguje se silylchloridem a imidazolem za vysokých koncentrací v dimethylformamidu (DMF).[1] Pokud je DMF nahrazen dichlorethanem, reakce probíhá o něco pomaleji, ale získání čisté sloučeniny je jednodušší. Zásadou běžně používanou s trifláty je 2,6-lutidin.[2] Primární alkoholy stačí chránit méně než hodinu, zatímco některé alkoholy se stericky ovlivněnými místy vyžadují řádově dny reakčního času.
Při použití silylchloridu nejsou obvykle potřeba zvláštní opatření s výjimkou zabránění přítomnosti většího množství vody. Lze použít nadbytek silylchloridu, což ovšem není nutné. Pokud je použit přebytek tohoto reaktantu, pak produkt musí projít sloupcovou chromatografií, kterou se odstraní pozůstatky silanolu a siloxanu. Silyltrifláty jsou citlivé na vodu a musí být umístěny v inertní atmosféře. Přečištění zahrnuje přidání vodného roztoku kyseliny, například nasyceného roztoku chloridu amonného, čímž se vypláchnou zbylé silylové sloučeniny a dojde k protonaci aminů, které se odstraní z reakční směsi. Po této extrakci lze produkt ještě přečistit sloupcovou chromatografií.
Odstranění silyletherové chránicí skupiny[3]
Silylová skupina se dá, když už ochrana molekuly není potřebná, odstranit reakcí s kyselinami nebo fluoridy jako je tetra-n-butylamoniumfluorid. Větší substituenty zvyšují odolnost vůči hydrolýze, ale také znesnadňují připojení silylových skupin.
Monoprotekce symetrických diolů
Monosilylaci symetrických diolů lze provést, ovšem občas může být problematická. Byla mimo jiné popsána následující monosilylace:[4]
Ukázalo se však, že je obtížné tuto reakci zopakovat. Pokud byla reakce řízená pouze termodynamicky, byl by dianion podobně reaktivní jako monoanion a vznikala by směs disilylovaného, monosilylovaného a nesilylovaného produktu v poměru 1:2:1. Reakce v THF je však ze dvou důvodů selektivní: kvůli kinetické deprotonaci prvního aniontu a nerozpustnosti monoaniontu. Po počátečním přidání TBSCl je v roztoku jen malá část monoaniontů, zbytek vytváří suspenzi. Tato malá část reaguje a posouvá rovnováhu monoaniontu směrem k roztoku, což umožňuje vysokou výtěžnost mono-TBS produktu. Lepších výsledků lze dosáhnout s N-butyllithiem:[5]
Selektivní deprotekce
Selektivní deprotekci silylových skupin lze provést mnoha způsoby. Příkladem může být syntéza taxolu:[6]
Silylethery se dělí do skupin hlavně na základě prostorového uspořádání a elektronové hustoty. Obecně lze říct, že kyselé deprotekce probíhají u méně stericky ovlivněných silylových skupin rychleji, jelikož má křemík větší sterický vliv než kyslík. Deprotekce založené na fluoridech jsou u silylových skupin s nízkou elektronovou hustotou rychlejší než u těch, které mají elektronovou hustotu vysokou. Existují určité důkazy, že některé silylové deprotekce probíhají přes hypervalentní sloučeniny křemíku.
Deprotekce silylových sloučenin byly podrobně prozkoumány. I když jich lze dosáhnout za nejrůznějších podmínek, tak jsou některé procesy výhodnější. Selektivní deprotekce bude nejpravděpodobněji úspěšná, pokud je mezi molekulami výrazný sterický rozdíl (například primární TBS a sekundární TBS nebo primární TES a primární TBS). Je ovšem potřeba použít určité optimalizace, deprotekce provádět jen částečně a recyklovat materiál.
- Příklady kyselých reakčních podmínek
- 100 mol% kyselina kafrosulfonová v MeOH, pokojová teplota, větší množství kyseliny; deprotekce primírních TBS skupin do deseti minut
- 10 mol% kyselina kafrosulfonová, MeOH:DCM 1:1, −20 až 0 °C; deprotekce primárních TBS skupin za dvě hodiny při 0 °C; pokud je kyselina nahrazena pyridinium p-toluensulfonátem, je reakce asi desetkrát pomalejší; s p-TsOH asi desetkrát rychlejší
- AcOH:THF:voda 4:1:1 v/v/v, pokojová teplota; velmi pomalá, ale i značně selektivní reakce
- Příklady zásaditých reakčních podmínek
Reference
V tomto článku byl použit překlad textu z článku Silyl ether na anglické Wikipedii.
- Corey, E. J.; Venkateswarlu, A. "Protection of hydroxyl groups as tert-butyldimethylsilyl derivatives." J. Am. Chem. Soc. 1972, 94, 6190–6191. DOI:10.1021/ja00772a043
- Corey, E. J.; Cho, H.; Rücker C.; Hua, D. H. "Studies with trialkylsilyltriflates: new syntheses and applications." Tetrahedron Lett. 1981, 22, 3455–3458. DOI:10.1016/S0040-4039(01)81930-4
- GREENE, T. W.; WUTS, P. G. M. Protective Groups In Organic Synthesis. New York: John Wiley & Sons, 1999. ISBN 9780471160199. S. 114. (anglicky)
- McDougal, P. G.; Rico, J. G.; Oh, Y.-I.; Condon, B. D. "A convenient procedure for the monosilylation of symmetric 1,n-diols." J. Org. Chem. 1986, 51, 3388–3390. DOI:10.1021/jo00367a033
- Roush, W. R.; Gillis, H. R.; Essenfeld, A. P. "Hydrofluoric acid catalyzed intramolecular Diels-Alder reactions " J. Org. Chem. 1983, 49, 4674–4682. DOI:10.1021/jo00198a018
- Holton, R. A. et al. "First total synthesis of taxol. 2. Completion of the C and D rings." J. Am. Chem. Soc. 1994, 116, 1599–1600. DOI:10.1021/ja00083a067
- Higashibayashi, S.; Shinko, K.; Ishizu, T.; Hashimoto, K.; Shirahama, H.; Nakata, M. "Selective deprotection of t-butyldiphenylsilyl ethers in the presence of t-butyldimethylsilyl ethers by tetrabutylammonium fluoride, acetic acid, and water." Synlett 2000, 1306–1308. DOI:10.1055/s-2000-7158
