Holtonova totální syntéza taxolu
Holtonova totální syntéza taxolu, kterou se svou skupinou zveřejnil Robert A. Holton v roce 1994, je první známá totální syntéza taxolu.[1][2]
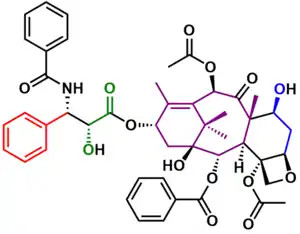
Holtonova totální syntéza taxolu patří mezi lineární syntézy, výchozí látkou je komerčně dostupná sloučenina patchoulenoxid,[3] epoxid získávaná ve dvou krocích z terpenu patchoulolu a z borneolu.[4][5]
Syntéza je enantioselektivní, z (−)-patchoulenoxidu vzniká (+)-taxol a z (−)-borneolu (−)-taxol se specifickou rotací ±47° (c=0,19 v MeOH). Holtonova syntéza je oproti jiným postupům poměrně krátká, obsahuje 46 lineárních kroků. Důvodem je převážně to, že patchoulenoxid obsahuje 15 z 20 uhlíkových atomů potřebných k tvorbě cyklické části molekuly taxolu.
Dalšími materiály používanými při této syntéze jsou penten-4-al, kyselina m-chlorperoxybenzoová, methylmagnesiumbromid a fosgen. Nejdůležitějšími přeměnami jsou zde Chanův přesmyk a oxidace sulfonyloxaziridinenolátu.
Retrosyntéza
Taxol (51) se získává navázáním postranního řetězce na Odžimův laktam 48 vzniklý z alkoholu 47. Ze čtveřice kruhů se nejpozději vytváří kruh D, a sice vnitromolekulární SN2 reakcí hydroxytosylátu 38, získatelného z hydroxyketonu 27. Tvorbu šestičlenného kruhu C lze provést Dieckmannovou kondenzací laktonu 23, vytvořitelného Chanovým přesmykem karbonátu 15. Sloučenina 15 může být připravena z ketonu 6, který vznikne několika oxidacemi a přesmyky z patchoulenoxidu 1.
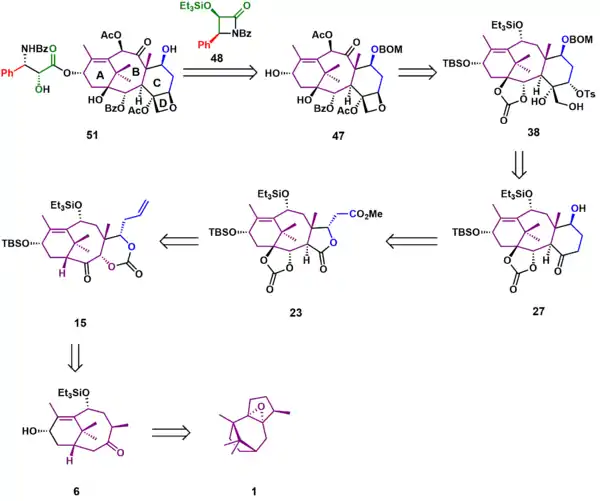
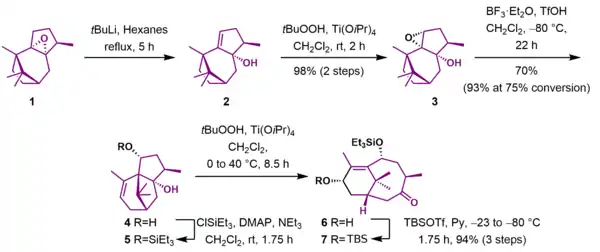
Syntéza kruhu AB
Reakcí epoxidu 1 s terc-butyllithiem byl odstraněn kyselý α-epoxidový proton, což vedlo k eliminaci a otevření epoxidového cyklu za vzniku allylového alkoholu 2. Tento alkohol byl epoxidován na epoxyalkohol 3 terc-butylhydroperoxidem a isopropoxidem titaničitým. Následně došlo za katalýzy fluoridem boritým jako Lewisovou kyselinou k otevření kruhu epoxidu, po němž následovaly přesmyk a eliminace za tvorby nenasyceného diolu 4. Nově vytvořená hydroxylová skupina byla ochráněna jako triethylsilylether (5). Spojením epoxidace kyselinou m-chlorperoxybenzoovou a Grobovy fragmentace katalyzované Lewisovou kyselinou vznikl keton 6, následně v třech krocích ochráněný v podobě terc-butyldimethylsilyletheru 7, s 94% výtěžností.
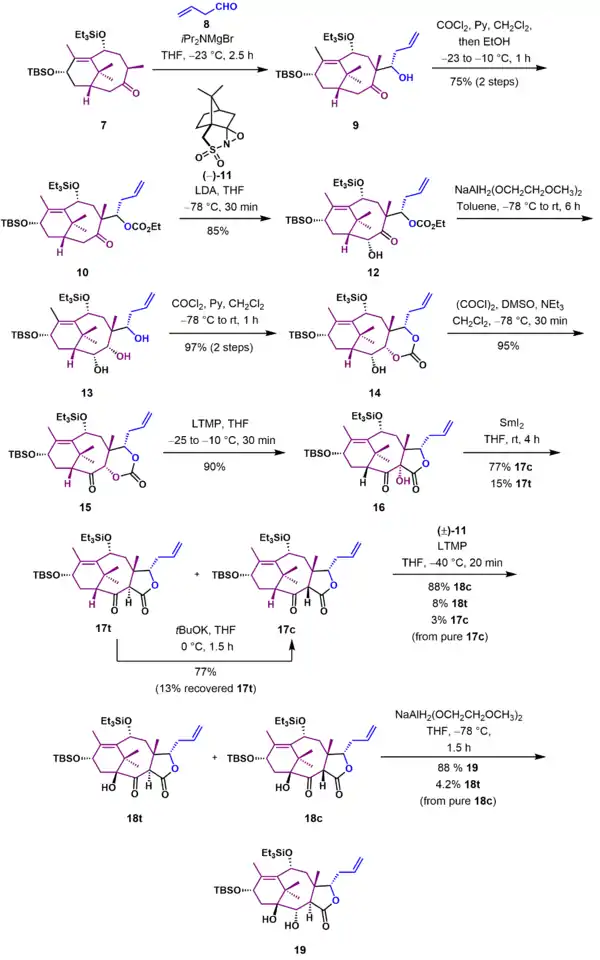
Příprava kruhu C
Další částí syntézy bylo navázání uhlíkových atomů potřebných k tvorbě kruhu C. Keton 7 reagoval s magnesiumbromiddiisopropylamidem v aldolové reakci s pentan-4-alem (8) za vzniku β-hydroxyketonu 9. Hydroxyl byl ochráněn karbonátovou skupinou (10). Oxidací enolátu ketonu 10 (-)-kamforsulfonyloxaziridinem (11) se vytvořil α-hydroxyketon 12. Redukcí tohoto ketonu pomocí 20 ekvivalentů bis(2-methoxyethoxy)hydridohlinitanem sodným se utvořil triol 13, následně reakcí s fosgenem převedený na karbonát 14. Swernovou oxidací alkoholu 14 se vytvořil keton 15. V následujícím kroku proběhla tvorba vazby potřebné pro spojení kruhů B a C Chanovým přesmykem sloučeniny 15 působením tetramethylpiperididu lithného za vzniku α-hydroxylaktonu 16 s 90% výtěžností. Byla odstraněna hydroxylová skupina reakcí s jodidem samarnatým za tvorby enolu, který prošel chromatografií na silikagelu, čímž se oddělily diastereomery cis 17c (77 %) a trans 17t (15 %), trans-izomer šlo přeměnit na 17c působením terc-butoxidu draselného. Reakcí čistého 17c s tetramethylpiperididem lithným a (±)-kamforsulfonyloxaziridinem se utvořily oddělitelné α-hydroxyketony 18c (88 %) a 18t (8 %) a menší množství výchozího materiálu (3 %). Redukcí čistého ketonu 18c bis(2-methoxyethoxy)hydridohlinitanem sodným a následné přidání zásady vedlo k epimerizaci na diol 19 s 88% výtěžností.
Syntéza kruhu C
Diol 19 byl reakcí s fosgenem ochráněn jako karbonátový ester (20). Koncová alkenová skupina sloučeniny 20 byla následně přeměněna na methylester ozonolýzou, oxidací manganistanem draselným a esterifikací diazomethanem. Rozšířením kruhu následně vznikl cyklický řetězec kruhu C 24 Dieckmanovou kondenzací laktonu 23 za použití diisopropylamidu lithného jako zásady, za teploty -78 °C. K dekarboxylaci 24 bylo potřeba navázat na hydroxyl 2-methoxy-2-propyletherovou skupinu (25); samotné dekarboxylace bylo dosaženo působením thiofenolátu draselného v dimethylformamidu, vznikl přitom chráněný hydroxyketon 26. V následujících dvou krocích proběhlo odpojení 2-methoxy-2-propyletherové chránicí skupiny, takto vzniklý alkohol 27 byl ochráněn jako benzyloxymethylether 28. Keton se přeměnil na trimethylsilylenolether 29, následně Rubottomovou oxidací kyselinou m-chlorperoxybenzoovou vznikl trimethylsilylovaný acyloin 30. Poslední uhlík vytvářející strukturu taxolu se do molekuly dostal Grignardovou reakcí ketonu 30 s methylmagnesiumbromidem v desetinásobném přebytku za tvorby terciárního alkoholu 31, výsledkem jehož reakce s Burgessovým činidlem (32) se stal exocyklický alken 33.
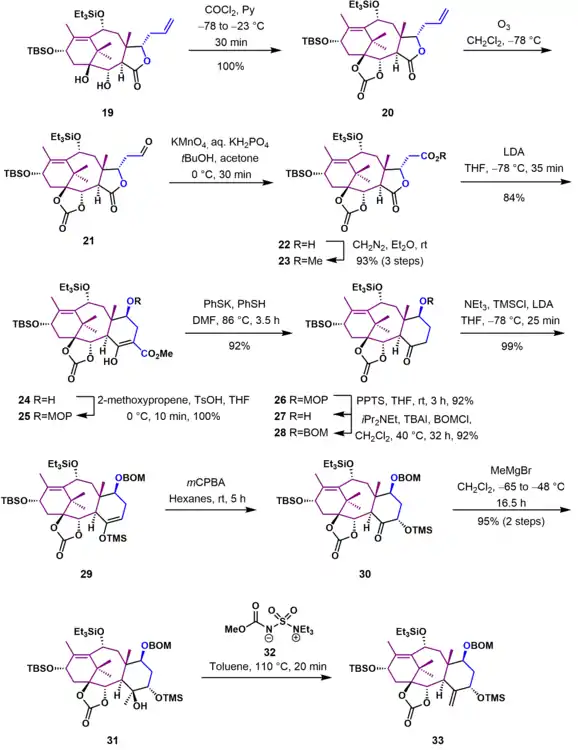
Syntéza kruhu D a úprava kruhu AB
V této části syntézy (viz obrázek 4) byl již dokončen kruh D a na kruh B byly navázány správné substituenty. Allylalkohol 34, získaný odpojením silylenoletherové chránicí skupiny z 33 kyselinou fluorovodíkovou, se oxidem osmičelým v pyridinu zoxidoval na triol 35. Po ochránění primárního hydroxylu byla sekundární hydroxylová skupina u 36 upravena na dobrou odstupující skupinu reakcí s 4-toluensulfonylchloridem. Po odvázání trimethylsilyletherové chránicí skupiny z 37 se utvořil tosylát 38, jenž byl poté cyklizován na oxetan 39 nukleofilním odštěpením tosylátu se změnou konfigurace. Dosud nechráněný terciární alkohol byl acylován a po odštěpení triethylsilylové skupiny vznikl alkohol 41. Odštěpení karbonátového esteru proběhlo působením fenyllithia v tetrahydrofuranu při -78 °C, vytvořil se jím alkohol 42. Nechráněná sekundární alkoholová skupina se zoxidovala na keton 43 ruthenistanem tetrapropylamonným a N-methylmorfolin-N-oxidem. Sloučenina prošla deprotonací terc-butoxidem draselným v tetrahydrofuranu a produkt byl dále oxidován benzenseleninanhydridem na α-hydroxyketon 44. Další reakcí 44 s terc-butoxidem draselným se odstranila α-hydroxyketonová skupina za vzniku sloučeniny 45 Lobryho-de Bruynovou–van Ekensteinovou přeměnou; tato sloučenina se poté zacylovala za tvorby α-acetoxyketonu 46.
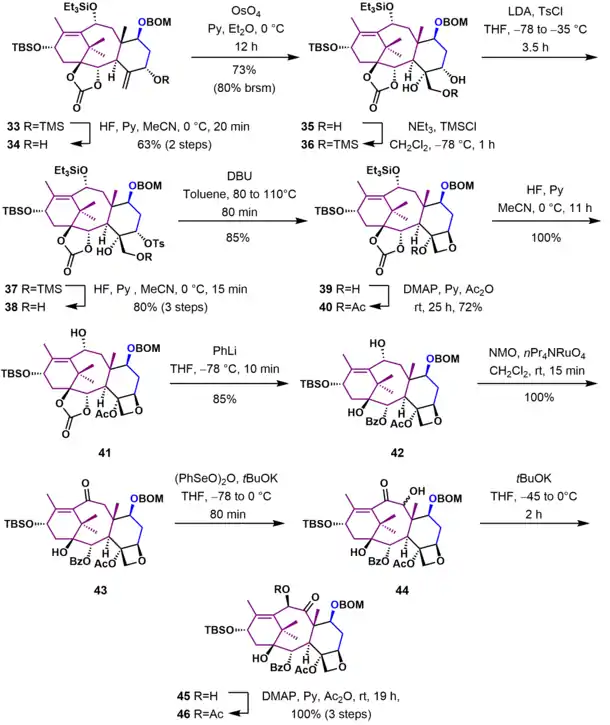
Navázání postranního řetězce
V konečné části syntézy byla zbavena chránicí skupiny a vznikl alkohol 47. Reakcí jeho lithného alkoxidu 47 s Odžimovým laktamem 48 se navázal postranní řetězec u 49. Odvázáním triethylsilyletherové chránicí skupiny působením kyseliny fluorovodíkové a benzyloxymethyletheru v redukčním prostředí se vytvořil (−)-taxol 51.
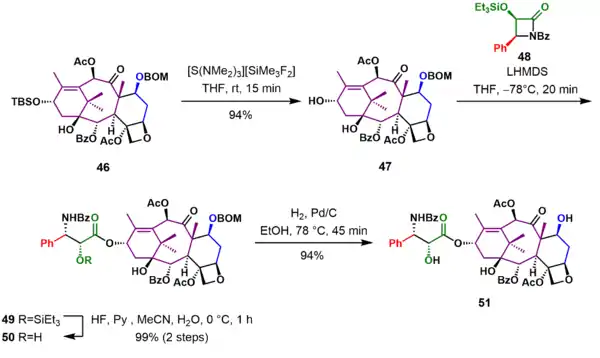
Příprava prekurzorů
Patchoulenoxid (1) se vytvořil z patchoulolu (52) posloupností kysele katalyzovaných karbokationtových přesmyků skrze eliminace v souladu s Zajcevovým pravidlem za vzniku patchoulenu (53). Epoxidací 53 kyselinou peroctovou se utvořil patchoulenoxid 1.
Chránicí skupiny
Benzyloxymethyl
Navázání: Benzyloxymethylchlorid, N,N-diisopropylethanamin, jodid tetrabutylamonný, refluxovaný dichlormethan
Odstranění: H2, Pd/C
Alkohol 27 byl ochráněn jako benzyloxymethylether, což je odolnější chránicí skupina než 2-methoxy-2-propyl.
Asymetrický karbonát
Navázání: fosgen, pyridin, ethanol v dichlormethanu, -23 až -10 °C.
Odstranění: Bis(2-methoxyethoxy)hydridohlinitan sodný
Sekundární alkoholová skupina penten-4-alového produktu aldolové reakce, 9, byl ochráněn jako asymetrický karbonátový ester. Odstranění proběhlo současně s redukcí ketonu 12 bis(2-methoxyethoxy)hydridohlinitanem sodným.
Cyklický karbonát [1]
Navázání: fosgen, pyridin, dichlormethan, -78 °C až pokojová teplota
Odstranění: Chanův přesmyk (působením tetramethylpiperididu lithného).
Cyklický karbonát se odštěpil při Chanově přesmyku u sloučeniny 15, čímž vznikla vazba uhlík–uhlík jako součást uhlíkového řetězce taxolu.
Cyklický karbonát [2]
Navázání: fosgen, pyridin, -78 až -23 °C
Odštěpení: fenyllithium v tetrahydrofuranu při -78 °C.
Diol 19 byl ochráněn jako cyklický karbonát, oddělený fenyllithiem v tetrahydrofuranu při 78 °C za vzniku hydroxybenzoátu 42.
2-methoxy-2-propyl
Navázání: kyselina p-toluensulfonová a 2-methoxypropen
Odstranění: tetra-n-butylamoniumfluorid (1 mol eq., tetrahydrofuran, -1 °C)
Hydroxyl u hydroxyesteru 24 byl ochráněn jako 2-methoxy-2-propylether, aby se zabránilo dekarboxylaci β-ketoesterové skupiny.
Terc-butyldimethylsilyl
Navázání: butyllithium, tetrahydrofuran, terc-butyldimethylsilylchlorid
Oddělení: Tris(dimethylamino)sulfoniumdifluortrimethylsilikát
Po Grobově fragmentaci byl vzniklý alkohol 6 ochráněn jako terc-butyldimethylsilylether 7, tato skupina byla odstraněna až před navazovaáním postranního řetězce.
Triethylsilyl [1]
Navázání: Triethylsilylchlorid, 4-dimethylaminopyridin, pyridin
Odvázání: Komplex kyseliny fluorovodíkové s pyridinem v acetonitrilu
Sekundární hydroxylová skupina diolu 4 byla chráněna jako triethylsilylether, aby se neúčastnila Grobovy fragmentace. Odštěpení bylo provedeno u 37, přičemž se obnovil alkohol.
Triethylsilyl [2]
Navázání: viz Odžimův laktam
Odstranění: Kyselina fluorovodíková, pyridin, acetonitril, 0 °C
Sekundární alkoholová skupina sloučeniny 48 musela být chráněna až do dokončení navazování postranního řetězce na sekundární hydroxyl kruhu A.
Trimethylsilyl [1]
Navázání: Diisopropylamid lithný, trimethylsilylchlorid
Odstranění: Kyselina fluorovodíková, pyridin, acetonitril.
Keton 25 byl ochráněn jako trimethylsilylenolether a následně oxidován kyselinou m-chlorperoxybenzoovou, přičemž se trimethylsilylová skupina přesunula na 2-hydroxyl.
Trimethylsilyl [2]
Navázání: Trimethylsilylchlorid
Odstranění: kyselina fluorovodíková, pyridin, acetonitril
Primární hydroxylová skupina triolu 35 byla ochráněna jako trimethylsilylether, aby mohla být uskutečněna aktivace sekundární hydroxylové skupiny tosylátem.
Odkazy
Související články
Externí odkazy
Reference
V tomto článku byl použit překlad textu z článku Holton Taxol total synthesis na anglické Wikipedii.
- Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, Hossain Nadizadeh, Yukio Suzuki, Chunlin Tao, Phong Vu, Suhan Tang, Pingsheng Zhang, Krishna K. Murthi, Lisa N. Gentile, Jyanwei H. Liu. First total synthesis of taxol. 1. Functionalization of the B ring. Journal of the American Chemical Society. 1994, s. 1597–1598. DOI 10.1021/ja00083a066.
- Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, Hossain Nadizadeh, Yukio Suzuki, Chunlin Tao, Phong Vu, Suhan Tang, Pingsheng Zhang, Krishna K. Murthi, Lisa N. Gentile, Jyanwei H. Liu. First Total Synthesis of Taxol. 2. Completion of the C and D Rings. Journal of the American Chemical Society. 1994, s. 1599–1600. DOI 10.1021/ja00083a067.
- Robert A. Holton; R. R. Juo; Hyeong B. Kim; Andrew D. Williams; Shinya Harusawa; Richard E. Lowenthal. A synthesis of taxusin. Journal of the American Chemical Society. 1988, s. 6558–6560. DOI 10.1021/ja00227a043.
- G. Büchi; William D. MacLeod; J. Padilla. Terpenes. XIX.1 Synthesis of Patchouli Alcohol2. Journal of the American Chemical Society. 1964-10-01, s. 4438–4444. ISSN 0002-7863. DOI 10.1021/ja01074a041.
- G. Büchi; R. E. Erickson; Nobel Wakabayashi. Terpenes. XVI.1,2 Constitution of Patchouli Alcohol and Absolute Configuration of Cedrene. Journal of the American Chemical Society. 1961-02-01, s. 927–938. ISSN 0002-7863. DOI 10.1021/ja01465a042.