Allylalkohol
Allylalkohol (systematický název prop-2-en-1-ol) je organická sloučenina se strukturním vzorcem H2C=CHCH2OH. Podobně jako mnoho dalších alkoholů je to ve vodě rozpustná bezbarvá kapalina, ovšem oproti většině nižších alkoholů je poněkud toxičtější. Používá se jako výchozí látka pro výrobu glycerolu, ale také jako prekurzor ohnivzdorných materiálů, vysychavých olejů a plastifikátorů.[2] K jeho výrobě se používá několik různých postupů.
| Allylalkohol | |
|---|---|
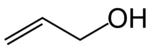
Strukturní vzorec | |
| Obecné | |
| Systematický název | prop-2-en-1-ol |
| Ostatní názvy | vinylkarbinol |
| Anglický název | Allyl alcohol |
| Sumární vzorec | C3H6O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 107-18-6 |
| PubChem | 7858 |
| ChEBI | 16605 |
| SMILES | C=CCO |
| InChI | 1S/C3H6O/c1-2-3-4/h2,4H,1,3H2 |
| Vlastnosti | |
| Molární hmotnost | 58,08 g/mol |
| Teplota tání | −129 °C (144 K) |
| Teplota varu | 97 °C (370 K) |
| Hustota | 0,854 g/cm3 |
| Rozpustnost ve vodě | mísitelný |
| Tlak páry | 2,3 kPa |
| Měrná magnetická susceptibilita | −6,32×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vzplanutí | 21 °C (294 K) |
| Teplota vznícení | 378 °C (651 K) |
| Meze výbušnosti | 2,5-18,0 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Allylalkohol poprvé připravili v roce 1856 Auguste Cahours a August Hofmann zmýdelněním allyljodidu.[2] V současnosti se komerčně většinou vyrábí zásaditou hydrolýzou allylchloridu:
- CH2=CHCH2Cl + NaOH → CH2=CHCH2OH + NaCl
Také jej lze získat přesmykem z propylenoxidu, reakce probíhá při vysoké teplotě a je katalyzována síranem draselno-hlinitým. Tato metoda má oproti výrobě z allylchloridu výhodu v tom, že nedochází ke vzniku soli, což platí rovněž pro další postup - „acetoxylaci“ propenu na allylacetát:
- 2 CH2=CHCH3 + O2 + 2 CH3COOH → 2 CH2=CHCH2OCOCH3 + 2 H2O
Hydrolýzou acetátu vzniká allylalkohol. Dále lze použít oxidaci propenu na akrolein, z nějž vznikne alkohol hydrogenací.
Další metody
Allylalkohol se teoreticky dá získat dehydrogenací propan-1-olu. K laboratorní přípravě se využívá reakce glycerolu s kyselinou šťavelovou nebo mravenčí.[3] Rovněž lze použít oxidaci allylových sloučenin oxidem seleničitým.
Použití
Allylalkohol je většinou převáděn na glycidol, jenž je meziproduktem výroby glycerolu, esterů a aminů. Rovněž se z něj dá vyrobit mnoho polymerizovatelných esterů jako je diallylftalát.
Bezpečnost
Allylalkohol je toxičtější než jiné podobné alkoholy. Také jde o lakrimátor.[2]
Reference
V tomto článku byl použit překlad textu z článku Allyl alcohol na anglické Wikipedii.
- Allyl alcohol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. pg. 7-11
- COHEN, Julius. Practical Organic Chemistry 2nd Ed.. London: Macmillan and Co., Limited, 1900. Dostupné online. S. 96. (anglicky)



