Vazba uhlík–uhlík
Vazba uhlík–uhlík je kovalentní vazba mezi dvěma atomy uhlíku.[1]
Nejčastější podobou je jednoduchá vazba, tvořená dvojicí elektronů, jedním z každého atomu. Jednoduchá vazba uhlík–uhlík je druhu sigma a vzniká překryvem jednoho hybridizovaného orbitalu z každého atomu. V molekule ethanu jde o sp3-hybridizované orbitaly, existují však i vazby mezi uhlíky majícími jiné druhy hybridizace (například sp2 a sp2). Atomy uhlíku v jednoduché vazby nemusí ani mít stejnou hybridizaci. Mezi uhlíky se též mohou nacházet dvojné (u alkenů) nebo trojné vazby (u alkynů). Dvojná vazba se tvoří překryvem sp2-hybridizovaného orbitalu a p orbitalu nezapojeného do hybridizace. Trojná vazba vzniká z sp-hybridizovaného orbitalu a dvou p orbitalů z každého atomu. Zapojení p orbitalů vytváří vazbu typu pí.
Řetězce a větvení
Uhlík je jedním z mála prvků, které mohou tvořit dlouhé řetězce svých vlastních atomů, tato vlastnost se nazývá katenace a je způsobena vysokými energiemi vazeb uhlík–uhlík, což umožňuje vytvářet obrovské množství uspořádání molekul; mnohé z nich jsou obsaženy v živých organismech, sloučeniny uhlíku tak mají vlastní chemické odvětví: organickou chemii.
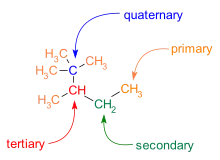
C-C řetězce jsou často rozvětvené. Uhlíkové atomy lze podle počtu dalších uhlíků na ně navázaných rozdělit takto:
- Na primární uhlík je navázán jeden další.
- Na sekundární se připojují dva.
- Terciární uhlík má na sebe připojené tři další uhlíky.
- Na kvartérní uhlíky jsou navázány čtyři jiné atomy uhlíku.
V „organických molekulách se složitou strukturou“ se vyskytují trojrozměrně uspořádané vazby uhlík–uhlík na kvartérních místech, které určují tvary molekul.[2] Tato kvartérní místa se nacházejí v řadě biologicky aktivních malých molekulách, jako jsou kortizon a morfin.[2]
Příprava
Reakce vytvářející vazby uhlík–uhlík mají velký význam při přípravě mnoha chemických látek, například léčiv a plastů.
Jako příklady reakcí lze uvést aldolové kondenzace, Dielsovy–Alderovy reakce, adice Grignardových činidel na karbonylové skupiny, Heckova reakce, Michaelova reakce a Wittigova reakce.
Postupy řízené syntézy trojrozměrných struktur obsahujících terciární uhlíky byly z velké části nalezeny do konce 20. století, ovšem syntézy sloučenin s kvaternárními uhlíky byly provedeny až začátkem 21. století.[2]
Délky a energie vazeb
Jednoduché vazby C-C jsou slabší než vazby C-H, O-H, N-H, H-H, H-Cl, C-F a řada dvojných či trojných vazeb, a podobně silné jako C-O, Si-O, P-O a S-H,[3] většinou jsou však považovány za silné.
| Vazba C–C | Molekula | Disociační energie vazby (kJ/mol) |
|---|---|---|
| CH3–CH3 | ethan | 380 |
| C6H5–CH3 | toluen | 430 |
| C6H5–C6H5 | bifenyl | 480 |
| CH3C(O)–CH3 | aceton | 350 |
| CH3–CN | acetonitril | 570 |
| CH3–CH2OH | ethanol | 370 |
Výše uvedené hodnoty patří k obvyklým pro vazby C-C; ojediněle se mohou objevit hodnoty výrazně mimo toto rozmezí.
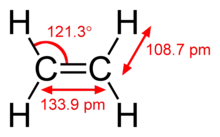
| Molekula | Ethan | Ethen | Ethyn |
|---|---|---|---|
| Vzoerc | C2H6 | C2H4 | C2H2 |
| Skupina | alkany | alkeny | alkyny |
| Struktura |  |
 |
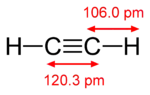 |
| Hybridizace uhlíků | sp3 | sp2 | sp |
| délka vazby C-C | 153,5 pm | 133,9 pm | 120,3 pm |
| Délka vazeb C-C ve srovnání s jednoduchými | 100 % | 87 % | 78 % |
| Metoda určení struktury | mikrovlnná spektroskopie | mikrovlnná spektroskopie | infračervená spektroskopie |
Mimořádné případy
Dlouhé a slabé jednoduché vazby C-C
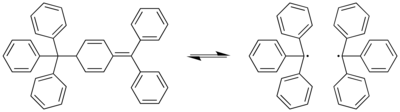
Bylo objeveno několik případů neobvykle dlouhých vazeb C-C. V Gombergově dimeru má jedna vazba C-C délku 159,7 pm. Právě tato vazba se v roztoku snadno (a vratně) narušuje i za pokojové teploty:[5]
U hexakis(3,5-di-terc-butylfenyl)ethanu je energie vazby vytvářející stabilizovaný triarylmethylový radikál pouze 30 kJ/mol. V důsledku silného sterického působení je také centrální vazba v této molekule výrazně prodloužená, a to na 167 pm.[6]
Slabé dvojné vazby C-C
Struktura tetrakis(dimethylamino)ethylenu (TDAE) je značně narušená. Diedrální úhel dvou N2C konců je 28º, i když délka vazby C=C činí běžných 135 pm. Téměř izostrukturní tetraisopropylethylen má tuto vazbu také 135 pm dlouhou, jeho C6 jádro je ovšem rovinné.[7]
Krátké a silné trojné vazby C-C
Opačným extrémem je stav, kdy má jednoduchá vazba uhlík–uhlík v butadiynu nezvykle vysokou energii 670 kJ/mol, protože jednoduchá vazba spojuje dva sp-hybridizované uhlíky.[8]
Násobné vazby C-C jsou obecně silnější než jednoduché; dvojná vazba v ethenu má disociační energii 730 kJ/mol a u trojné vazby ethynu jde o 960 kJ/mol.[9]
Velmi krátkou trojnou vazbu (115 pm) pozorovanou u jodoniové sloučeniny [HC≡C–I+Ph][CF3SO3–], lze vysvětlit silným odtahováním elektronů jodonovou skupinou.[10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Carbon–carbon bond na anglické Wikipedii.
- Harry Dembicki. Practical Petroleum Geochemistry for Exploration and Production. [s.l.]: Elsevier, 2016-10-06. ISBN 9780128033517. S. 7.
- Quasdorf, Kyle W.; OVERMAN, LARRY E. Review: Catalytic enantioselective synthesis of quaternary carbon stereocentres. Nature. 2014, s. 181–191. DOI 10.1038/nature14007. PMID 25503231. Bibcode 2014Natur.516..181Q. (anglicky)
- Yu-Ran Luo and Jin-Pei Cheng "Bond Dissociation Energies" in CRC Handbook of Chemistry and Physics, 96th Edition.
- CRC Handbook of Chemistry and Physics, 88th edition
- L. N. Bochkarev; N. E. Molosnova; L. Zakharov; G. K. Fukin; A. I. Yanovsky; Y. T. Struchkov. 1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate. Acta Crystallographica Section C Crystal Structure Communications. 1995, s. 489–491. DOI 10.1107/S0108270194009005.
- Sören Rösel; Ciro Balestrieri; Peter R. Schreiner. Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane. Chemical Science. 2017, s. 405–410. ISSN 2041-6520. DOI 10.1039/c6sc02727j. PMID 28451185.
- Hans Bock; Horst Borrmann; Zdenek Havlas; Heinz Oberhammer; Klaus Ruppert; Arndt Simon. Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase. Angewandte Chemie International Edition in English. 1991, s. 1678–1681. DOI 10.1002/anie.199116781.
- NIST Webbook [online]. Dostupné online.
- Stephen J. Blanksby; G. Barney Ellison. Bond Dissociation Energies of Organic Molecules. Accounts of Chemical Research. 2003, s. 255–263. ISSN 0001-4842. DOI 10.1021/ar020230d.
- Andrew Streitwieser; Clayton H. Heathcock; Edward M. Kosower. Introduction to organic chemistry. [s.l.]: Prentice Hall, 1992. ISBN 978-0139738500. S. 574.