Acyloin
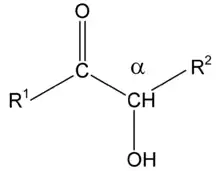
Acyloiny jsou skupinou organických sloučenin, které mají α-hydroxyketonovou funkční skupinu, mají tedy hydroxyl na pozici α (vzhledem ke karbonylové skupině). Pojmenování acyloin bylo odvozeno ze skutečnosti, že jsou tyto látky formálně odvozeny redukčním spárováním acylových skupin karboxylových kyselin.
Příprava acyloinů
Existuje několik postupů, kterými lze připravit acyloiny:
- Acyloinová kondenzace je redukční párování esterů
- Benzoinová kondenzace je kondenzační reakce mezi aldehydy katalyzovaná nukleofilem.
- Oxidací karbonylových sloučenin molekulárním kyslíkem (tato reakce není selektivní)
- Lepším způsobem je oxidace odpovídajících silylenoletherů kyselinou meta-chlorperoxybenzoovou (Rubottomova oxidace)
- Oxidací pomocí oxodiperoxymolybden(pyridin)-(hexamethyltriamidu fosforečného) (MoOPH) v systému s peroxidem molybdeničným, pyridinem a hexamethylfosforamidem (HMPA)
Oxidace enolátů sulfonyloxaziridiny
Enoláty mohou být oxidovány sulfonyloxaziridiny.[1][2] Enolát nukleofilně reaguje s kyslíkem s nedostatkem elektronů v oxaziridinovém řetězci:
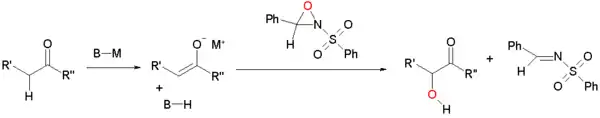
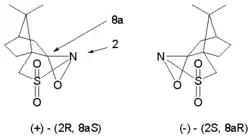
Tuto reakci je možné přeměnit na asymetrickou syntézu použitím opticky aktivních izomerů oxaziridinů odvozených z kafru. Z každého výchozího izomeru vzniká jiný z možných enantiomerů. Této modifikace se využívá při Holtonově syntéze taxolu:
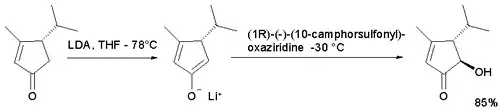
Níže zobrazenou enolátovou oxidací cyclopentaenonu[3] s jiným kafrovým enantiomerem vzniká transizomer, jelikož je přístup k hydroxylové skupině v poloze cis omezen (při použití samotného oxaziridinu nevznikne acyloin)[3]:
Reakce acyloinů
- Redukcí acyloinů vznikají dioly.
- Oxidací acyloinů vznikají diony.
- U některých acyloinů probíhá přesmyk pod vlivem zásady (Lobryho–de Bruynova–van Ekensteinova transformace).
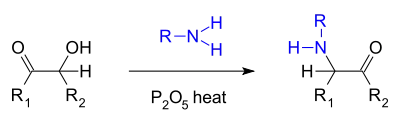
- Podobnou reakcí je Voigtova aminace[4], kde acyloin reaguje s primárním aminem a oxidem fosforečným za vzniku α-keto aminu:[5]
- Bischler-Möhlauova syntéza indolů[6]
Reference
V tomto článku byl použit překlad textu z článku Acyloin na anglické Wikipedii.
- DAVIS, Franklin A.; VISHWAKARMA, Lal C.; BILLMERS, Joanne G.; FINN, John. Synthesis of α-hydroxycarbonyl compounds (acyloins): direct oxidation of enolates using 2-sulfonyloxaziridines. J. Org. Chem.. 1984, roč. 49, čís. 17, s. 3241–3243. DOI 10.1021/jo00191a048. (anglicky)
- DAVIS, F. A.; HAQUE, M. S.; ULATOWSKI, T. G.; TOWSON, J. C. Asymmetric oxidation of ester and amide enolates using new (camphorylsulfonyl)oxaziridines. J. Org. Chem.. 1986, roč. 51, s. 2402. DOI 10.1021/jo00362a053. (anglicky)
- HUGHES, Chambers C.; MILLER, Aubry K.; TRAUNER, Dirk. An Electrochemical Approach to the Guanacastepenes. Organic Letters. 2005, roč. 7, čís. 16, s. 3425–3428. Dostupné v archivu pořízeném dne 4 September 2006. DOI 10.1021/ol047387l. (anglicky) Archivováno 4. 9. 2006 na Wayback Machine Archivovaná kopie. www.cchem.berkeley.edu [online]. [cit. 2018-01-09]. Dostupné v archivu pořízeném z originálu.
- VON MEYER, E.; VOIGT, Karl. Ueber die Einwirkung von primären aromatischen Aminen auf Benzoïn. Journal für Praktische Chemie. 1886, roč. 34, čís. 1, s. 1–27. DOI 10.1002/prac.18860340101. (German)
- LAWRENCE, Stephen A. Amines: Synthesis, Properties and Applications. [s.l.]: Cambridge University Press, 2004. ISBN 0-521-78284-8.
- ROTH, Lepke. Synthese von Indol- und Carbazol-Derivaten aus α-Hydroxyketonen und aromatischen Aminen. Arch. Pharm.. 1972, roč. 305, čís. 3, s. 159–171. DOI 10.1002/ardp.19723050302. (German)