Trimethylsilyl
Trimethylsilyl (zkráceně TMS) je funkční skupina se třemi methylovými skupinami navázanými na atom křemíku se vzorcem (CH3)3Si-. Tato skupina bývá nereaktivní a objemná, díky čemuž je využitelná v řadě syntéz.
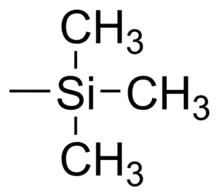
Trimethylsilylová skupina navázaná na vodík vytváří trimethylsilan, pro který se také používá zkratka TMS.
V přírodě se obvykle trimethylsilylové skupiny nevyskytují. Při organické syntéze se někdy pomocí trimethylsilylačních činidel zavádí do molekul netěkavých sloučenin, jako jsou alkoholy, fenoly a karboxylové kyseliny, kdy nahrazuje vodík v hydroxylu; vznikají tak trimethylsiloxy skupiny. K nejčastějším trimethylsilylačním činidlům patří například trimethylsilylchlorid a bis(trimethylsilyl)acetamid. Trimethylsilylové skupiny v molekulách zvyšují jejich těkavost, díky čemuž lze tyto sloučeniny snadněji analyzovat pomocí plynové chromatografie.
Trimethylsilyl lze také použít jako chránicí skupinu.
V chromatografii se ve stacionárních fázích používají trimethylsilylové skupiny navázané na silanoly.
Vysoce reaktivní sloučeniny je možné izolovat, pokud jsou obklopeny trimethylsilylovými skupinami. Tento jev se objevuje u tetraedranů.
Super silylové skupiny
silyl.png.webp)
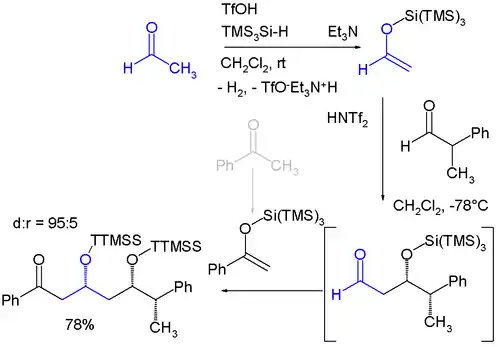
Trimethylsilylové skupině se podobají „super“ silylové skupiny, které existují ve dvou variantách: křemík s třemi trimethylsilyly vytváří tris(trimethylsilyl)silylovou skupinu (TTMSS nebo TMS3Si), druhou možností je křemík s třemi navázanými terc-butylovými skupinami. Existenci TTMSS navrhl roku 1993 Hans Bock. S Van der Waalsovým objemem kolem 7 krychlových ångströmů převyšuje i TIPS skupinu, u níž jde o přibližně 2 krychlové ångströmy.[1][2] Má potenciální využití jako dočasný substituent při asymetrické syntéze, například při níže zobrazené diastereoselektivní reakci skládající se ze dvou Mukaijamových aldolových adicí, kdy reagují acetaldehyd a benzofenon, které jsou oba převedeny na silylenolethery reakcí s tris(trimethylsilyl)silanem a kyselinou trifluormethansulfonovou za vývinu vodíku. Reakci katalyzuje bis(trifluormethan)sulfonimid.
Zkratka TTMSS se rovněž používá pro tris(trimethylsilyl)silan,[3][4] který je jako reaktant podobný tributylcínu, ovšem je jakožto organická sloučenina cínu toxický.[5][6] Používá se jako katalyzátor při radikálových redukcích, hydrosilylačních a kaskádových radikálových reakcích.[7]
Ochrana alkoholů

V organické syntéze se trimethylsilylové skupiny používají k ochraně alkoholů.
Nejčastější způsoby ochrany molekul

- Trimethylsilylchlorid (TMSCl) nebo trimethylsilyltrifluormethansulfonát (TMSOTf) za přítomnosti zásady (například pyridinu, triethylaminu nebo 2,6-lutidinu) v dichlormethanu[8][9][10][11][12]
- TMSCl a sulfid lithný (Li2S) v acetonitrilu
Nejčastější způsoby odstraňování chránicí skupiny
- Tetrabutylamoniumfluorid v tetrahydrofuranu
- Reakce s kyselinou hexafluorokřemičitou
- Reakce s HCl v THF/vodném roztoku
Reference
V tomto článku byl použit překlad textu z článku Trimethylsilyl na anglické Wikipedii.
- "Super Silyl" Group for Diastereoselective Sequential Reactions: Access to Complex Chiral Architecture in One Pot Matthew B. Boxer and Hisashi Yamamoto J. Am. Chem. Soc.; 2007; 129(10) pp 2762 - 2763; (Communication) DOI:10.1021/ja0693542
- Tris(trimethylsilyl)silyl-Governed Aldehyde Cross-Aldol Cascade Reaction Boxer, M. B.; Yamamoto, H. J. Am. Chem. Soc.; (Communication); 2006; 128(1); 48-49. DOI:10.1021/ja054725k
- Tris(trimethylsilyl)silane 97% [online]. Sigma-Aldrich Co. LLC. [cit. 2014-05-05]. Dostupné online.
- Chryssostomos Chatgilialoglu; Carla Ferreri; Yannick Landais; Vitaliy I. Timokhin. Thirty Years of (TMS)3SiH: A Milestone in Radical-Based Synthetic Chemistry. Chemical Reviews. 2008-25-06, s. 6516–6572. DOI 10.1021/acs.chemrev.8b00109. PMID 29938502.
- Michael A. Brook. Silicon in Organic, Organometallic, and Polymer Chemistry. [s.l.]: John Wiley & Sons, Inc., 2000. Dostupné online. S. 172-173.
- Tris(trimethylsilyl)silane, TTMSS [online]. https://www.organic-chemistry.org [cit. 2014-05-05]. Dostupné online.
- Recent Applications of the (TMS)3SiH Radical-Based Reagent Chryssostomos Chatgilialoglu, Jacques Lalevée Molecules 2012, 17, 527-555; DOI:10.3390/molecules17010527
- K. C. Nicolaou; J. J. Liu; C.-K. Hwang; W.-M. Dai; R. K. Guy. Synthesis of a fully functionalized CD ring system of taxol. Journal of the Chemical Society, Chemical Communications. 1992-01-01, s. 1118. Dostupné online. ISSN 0022-4936. DOI 10.1039/c39920001118.
- K. C. Nicolaou; Zhen Yang; Erik J. Sorensen; Masahisa Nakada. Synthesis of ABCtaxoid ring systems via a convergent strategy. Journal of the Chemical Society, Chemical Communications. 1993-01-01, s. 1024. Dostupné online. ISSN 0022-4936. DOI 10.1039/c39930001024.
- K. C. Nicolaou; C.-K. Hwang; Erik J. Sorensen; C. F. Clairborne. A convergent strategy towards taxol. A facile enantioselective entry into a fully functionalized ring A system. Journal of the Chemical Society, Chemical Communications. 1992-01-01, s. 1024. Dostupné online. ISSN 0022-4936. DOI 10.1039/c39920001117.
- Total synthesis of taxol. Nature. 1994-02-17, s. 630–634. DOI 10.1038/367630a0. PMID 7906395. Bibcode 1994Natur.367..630N.
- K. C. Nicolaou; Christopher F. Claiborne; Philippe G. Nantermet; Elias A. Couladouros; Erik J. Sorensen. Synthesis of Novel Taxoids. Journal of the American Chemical Society. 1994-02-01, s. 1591–1592. ISSN 0002-7863. DOI 10.1021/ja00083a063.