Kyselina peroctová
Kyselina peroctová (též kyselina peroxooctová, kyselina peroxyoctová, systematický název kyselina peroxyethanová PAA) je chemická sloučenina ze skupiny organických peroxidů, sumární vzorec je C2H4O3. Je to čirá bezbarvá kapalina s charakteristickým ostrým octovým zápachem. Má silný oxidační potenciál a je silnou žíravinou. Koncetrovaná kyselina peroctová je nestabilní a nebezpečnou výbušninou.[2]
| Kyselina peroctová | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | kyselina peroxyethanová |
| Triviální název | kyselina peroctová |
| Ostatní názvy | kyselina peroxyoctová acetylhydroperoxid |
| Latinský název | Acidum peraceticum |
| Anglický název | Peracetic acid |
| Německý název | Peroxyessigsäure |
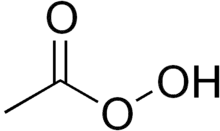
| Funkční vzorec | CH3COOOH |
| Sumární vzorec | C2H4O3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 79-21-0 |
| EC-no (EINECS/ELINCS/NLP) | 201-186-8 |
| Indexové číslo | 607-094-00-8 |
| SMILES | CC(=O)OO |
| Číslo RTECS | SD8750000 |
| Vlastnosti | |
| Molární hmotnost | 76,05 g/mol |
| Teplota tání | 0,1 °C |
| Teplota varu | 105 °C |
| Hustota | 1,13 g/cm³ |
| Dynamický viskozitní koeficient | 3,280 cP |
| Disociační konstanta pKa | 8,20 |
| Rozpustnost ve vodě | neomezená |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H226 H242 H332 H312 H302 H314 H400 |
| R-věty | R7 R10 R20/21/22 R35 R50 |
| S-věty | (S1/2) S3/7 S14 S36/37/39 S45 S61 |
| NFPA 704 |  2
3
4
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Kyselina peroctová se vyrábí nepřetržitým přidáváním kyseliny octové a peroxidu vodíku do vodného reakčního média obsahujícího kyselinu sírovou jako katalyzátor. Reakce se nechává probíhat až 10 dní, aby se dosáhlo vysoké výtěžnosti produktu podle následující rovnice[3]:
- CH3COOH + H2O2 ↔ C2H4O3 + H2O
Kyselina peroctová se vždy prodává jako roztok s kyselinou octovou a peroxidem vodíku, aby byla zajištěna chemická stabilita. Koncentrace kyseliny jako aktivní složky je různá, obvykle záleží na způsobu použití. Další metodou přípravy kyseliny je oxidace acetaldehydu nebo alternativně může jít o cílový produkt reakce anhydridu kyseliny octové, peroxidu vodíku a kyseliny sírové. Jiná metoda je založena na reakci tetraacetylethylendiaminu (TAED) za přítomnosti zásaditého roztoku peroxidu vodíku[3]. Kyselina peroctová přirozeně vzniká v životním prostředí sérií fotochemických reakcí, zahrnujících formaldehyd a fotooxidační radikály[4].
Použití
Antimikrobiální činidlo
Kyselina peroctová je ideálním antimikrobiálním činidlem, díky svému vysokému oxidačnímu potenciálu. Je široce účinná proti mikroorganismům a není deaktivována katalázou a peroxidázou, enzymy rozkládajícími peroxid vodíku. Rozpadá se na látky bezpečné pro potraviny i životní prostředí (kyselinu octovou a peroxid vodíku) a proto ji lze použít pro bezoplachové aplikace. Kyselinu peroctovou lze používat v širokém rozmezí teplot (0–40 °C), širokém rozmezí pH (3,0–7,5), v procesech clean-in-place (CIP, čištění bez rozebírání), v prostředí s tvrdou vodou, není ovlivňována zbytky bílkovin.
Mechanismus účinku
Kyselina peroctová ničí mikroorganismy oxidací (hydroxylovým radikálem (OH)) a následným rozpadem jejich buněčných membrán. Protože je difuze pomalejší než poločas života radikálu, reaguje s jakoukoli oxidovatelnou sloučeninou ve své blízkosti. Může poškodit téměř všechny typy makromolekul spojené s mikroorganismy: sacharidy, nukleové kyseliny (mutace), lipidy (lipidová peroxidace) a aminokyseliny (např. konverzí Phe na m-Tyr a o-Tyr). To nakonec vede k lýze buňky a smrti mikroorganismu.
Použití
Americká organizace EPA poprvé zaregistrovala kyselinu peroctovou jako antimikrobiální látku v roce 1985, a to pro použití na tvrdé povrchy v interiérech. Případy použití zahrnují např. zemědělské objekty, výrobny potravin, zdravotnická zařízení a koupelny v domácnostech. Kyselina peroctová je též registrována pro použití v mlékárnách a sýrárnách, na zařízení pro výrobu potravin, pasterizéry v pivovarech, vinařských závodech a dalších výrobnách nápojů[5]. Používá se také pro dezinfekci lékařské techniky, jako prevence tvorby biofilmu v papírnách, a k čištění a dezinfekci vody. Kyselinu peroctovou lze použít i k dezinfekci vody v chladicích věžích, kde brání tvorbě biofilmu a umožňuje účinně bojovat s bakterií Legionella.
V České republice má použití kyseliny peroctové k dezinfekci ještě mnohem delší historii. Dezinfekční přípravek Persteril se vyrábí od roku 1966, na trhu je řada dalších přípravků obsahujících kyselinu peroctovou. Přípravky s kyselinou peroctovou mají úplné spektrum dezinfekční účinnosti (A, B, C, T, M, V)[6].
Chemická syntéza
Kyselinu peroctovou lze použít jako chemikálii pro syntézu, kdy se její oxidační vlastnosti využívají k přidávání atomu kyslíku do dvojných vazeb, např. v ethenu a propenu, pro tvorbu epoxidů a alkoholů. Lze ji použít i pro syntézu glycerolu z propenu, a též při výrobě polyamidů[7].
Bělicí činidlo
Kyselinu peroctovou lze využí i jako bělicí činidlo. Protože uvolňuje kyslík výrazněji a při nižších teplotách než jiná bělidla, je jemnější k běleným materiálům. Bělení buničiny peroctovou kyselinou poskytuje papír, který neobsahuje žádných chlor (označovaný TCF, angl. Totally Chlorine Free).
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina peroctová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina peroctová na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Peracetic acid na anglické Wikipedii.
- Peracetic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- (anglicky)Safety Forum
- United States Department of Agriculture. Agriculture Marketing Service Peracetic acid. (PDF document). URL accessed on 11 November 2006.
- U.S. National Library of Medicine. Hazardous Substances Data Bank. URL accessed on 11 November 2006.
- U.S. Environmental Protection Agency. Hydrogen Peroxide and Peroxyacetic Acid. URL accessed on 11 November 2006.
- Dezinfekční prostředek PERSTERIL®
- KEMI - Information on Substances. Peracetic Acid Archivováno 8. 1. 2011 na Wayback Machine. URL accessed on 11 November 2006.



