Karbokation
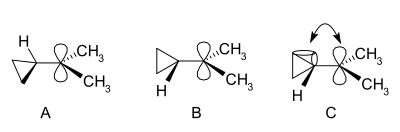
Karbokation je ion s kladným nábojem na atomu uhlíku. K nejjednodušším případům patří methenium (CH +
3 ), methanium (CH +
5 ) a vinylový kation (C2H +
3 ). Existují také karbokationty s více nabitými uhlíky, například ethylenový dikation (C2H 2+
4 ).[1]

Do začátku 70. let 20. století se všechny karbokationty označovaly jako karboniové ionty.[2] V současné definici Mezinárodní unie pro čistou a užitou chemii (IUPAC) je karbokation jakýkoliv kation se sudým počtem elektronů , který má významný kladný náboj na atomu uhlíku. Dále se dělí do dvou skupin podle koordinačních čísel nabitých uhlíkových atomů: pokud jsou tři, jedná se o karbeniový ion a v případě koordinačního čísla 5 jde o ion karboniový. Toto názvosloví navrhl George Andrew Olah.[3] Karboniové ionty mají tricentrické dvouelektronové delokalizované vazby a jsou tak totožné s neklasickými „karbokationty“, které obsahují můstkové σ vazby C–C nebo C–H. Jiné definice popisují 'karboniový ion' jako formálně protonovaný nebo alkylovaný alkan (CR +
5 , kde R je H nebo alkyl), čímž vylučují neklasické karbokationty, jako je 2-norbornyl.[4]
Definice
Podle Mezinárodní unie pro čistou a užitou chemii (IUPAC]) je karbokation každý kation se sudým počtem elektronů a významným kladným nábojem na atomu uhlíku.[5] Před prvním pozorováním pentakoordinovaných karbokationtů byly termíny karbokation a karboniový ion navzájem zaměňovány. George Andrew Olah navrhl změnu definice karboniového iontu jako karbokationtu obsahujícího tricentrickou dvouelektronovou vazbu, zatímco jako karbeniové se měly označovat karbokationty obsahující pouze dicentrické vazby a trikoordinované kladně nabité atomy uhlíku. Následně jiní navrhli označení karboniové ionty pro částice (alespoň formálně) vytvořené elektrofilním atakem H+ nebo R+ na alkan, podobně jako jsou od ostatních prvků hlavní skupiny odvozené oniové ionty, zatímco karbokationty obsahující jakýkoliv druh tricentrické dvouelektronové vazby se měly označovat jako neklasické karbokationty; 2-norbornylový kation by tak podle této definice nebyl karboniovým iontem, protože je formálně odvozen protonací alkenu (norbornenu) a ne alkanu, i když jde v důsledku můstkovité struktury o neklasický karbokation. IUPAC doporučuje používání právě tohoto názvosloví.
Od konce 90. let 20. století se většinou přestává používat označení karbonový ion pro klkasické trikoordinované karbokationty, někdy se však používají označení karbeniový ion a karbokation jako synonyma,[6][7] nebo se označení karbokation používá v minimální souvislosti se starým označováním karboniových[8] nebo karbeniových a karbonových iontů.
Karbokation s dikoordinovaným kladně nabitým uhlíkem odvozeným formálním navázáním hydridového iontu (H−) na alken se nazývá vinylový kation. Pokud tomu nebrání geometrické důvody, tak většina substituovaných vinylových kationtů má kladný náboj na sp-hybridizovaném uhlíku s lineární geometrií. Ion obsahující dikoordinovaný a přibližně sp2-hybridizovaný kladně nabitý uhlík, odvozený od arenu, se nazývá arylový kation. Tyto karbokationty (obzvláště pak arylové) jsou poměrně nestálé a vyskytují se vzácně; často tak v učebnicích nejsou zmiňovány. Podle IUPAC se jako karbokationty označují pouze částice se sudým počtem elektronů; radikálové kationty, jako je CH •+
4 , často se objevující v hmotnostní spektrometrii, se k nim obvykle neřadí.
Historie
V roce 1891 G. Merling[9] provedl adici bromu na tropyliden (cykloheptatrien) a zahříváním produktu získal krystalický produkt rozpustný ve vodě, C7H7Br. Nenavrhl pro něj žádnou strukturu; William von Eggers Doering a L. H. Knox[10] ale zjistili, že jde o bromid tropylia. Tento ion by podle Hückelova pravidla měl být aromatický.
V roce 1902 bylo zjištěno, že bezbarvý trifenylmethanol vytváří v koncentrované kyselině sírové tmavě žlutý roztok. Podobně trifenylmethylchlorid tvoří oranžové komplexy s chloridem hlinitým a cínatým. Roku 1902 Adolf von Baeyer zjistil, že se tyto sloučeniny chovají jako soli. Tritylový karbokation (znázorněný níže) našel využit v organické syntézeí jako stabilní homogenní katalyzátor.[11]
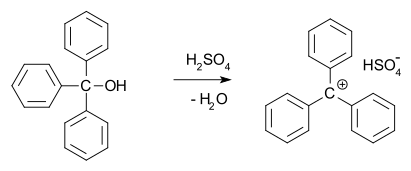
Karbokationty jsou reaktivními meziprodukty řady organických reakcí. Tuto myšlenku, již navrhl Julius Stieglitz v roce 1899,[12] poté dále rozvedl v roce 1922 Hans Meerwein[13][14] při zkoumání Wagnerova–Meerweinova přesmyku. Také bylo zjištěno, že se karbokationty zapojují do SN1, a E1 reakcí a přesmykových reakcí, jako je například Whitmorův 1,2-přesmyk.
První NMR spektrum stabilního karbokationtu v roztoku získali W. von E. Doering et al.[15] v roce 1958; jednalo se o heptamethylbenzeniový ion, připravený reakcí hexamethylbenzenu s chlormethanem a chloridem hlinitým. Roku 1960 byl získán stabilní 7-norbornadienylový kation[16] reakcí norbornadienylchloridu a tetrafluorboritanu stříbrného v oxidu siřičitém při −80 °C. NMR spektrum poté ukázalo, že šlo o neklasický (dokonce první známý stabilní neklasický karbokation) ion.
V roce 1962 George Andrew Olah pozoroval NMR spektroskopií terc-butylový karbokation po rozpuštění terc-butylfluoridu v magické kyselině. NMR norbornylového kationtu poprvé popsali Paul von R. Schleyer et al.[17][18]
Struktura a vlastnosti
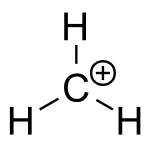
Karboniové ionty lze považovat za protonované alkany. Přestože jsou alkany většinou považovány za netečné, tak za určitých podmínek (například přítomnosti HF/SbF5) může sigma vazba C–H fungovat jako donor H+., tím vzniká částice obsahující 3c-2e vazbu mezi uhlíkem a dvěma atomy vodíku, druh vazby častý u sloučenin boru, ovšem méně běžný v případě uhlíku. 3c-2e vazby karboniových iontů je také možné považovat za molekuly Karboniové ionty se často rozkládají za uvolnění molekulového vodíku a vzniku příslušných karbeniových iontů.
U methaniového iontu (CH +
5 má podle výpočtů nejnižší energii struktura s Cs symetrií. Další možné struktury iontu mají však podobné energie a jsou odděleny nízkými bariérami a struktura iontu tak často bývá popisována jako proměnlivá. Přestože se může zdát, že jsou atomy uhlíku v karboniových iontech pětivazné, tak je ve skutečnosti okolo centrálního atomu jen pět elektronů, jak odpovídá přítomnosti 3c-2e vazby.
Karbeniové ionty jsou, alespoň formálně, odvozeny protonací (navázáním H+) nebo alkylací (navázáním R+) na karben nebo alken. V nejméně jedné ze svých rezonančních struktur tak mají atom uhlíku s kladným nábojem, který je obklopen šesti valenčními elektrony namísto obvyklých osmi (odpovídajících oktetovému pravidlu). Karbeniové ionty (a i jiné karbokationty) tak snahou doplnit počet elektronů do osmi a také zpětně získat elektrickou neutralitu vykazují značnou reaktivitu. Podle teorie VSEPR a Bentova pravidla tak jsou trikoordinované karbeniové ionty, pokud se nebjevují silné geometrické efekty, vynucující pyramidální tvar (například u 1-adamantylového kationtu), obvykle ve tvaru trojúhelníku, přičemž prázdný orbital má povahu jako orbital p a nejnižší neobsazený molekulový orbital (LUMO) vazby CH/CC vzniká z C(sp2) orbitalů. Jako příklad je možné uvést methylový kation, CH +
3 . Ze stejných dlvodl mají dikoordinované karbokationty (vinylové kationty) obvykle lineární geometrie a vazby CH/CC u nich vznikají z C(sp) orbitalů.
.png.webp)
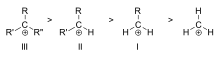
Stabilita alkylovaných karbokationtů klesá v řadě 3° > 2° > 1° > methyl, což odpovídá afinitám hydridových iontů (967, 1030, 1140 a 1310 kJ/mol u (CH3)3C+, (CH3)2CH+, CH3CH +
2 a CH +
3 ).[19] Vliv alkylace je výrazný: terciární karbokationty jsou natolik stabilní, že mnohé z nich lze pozorovat v superkyselinách, zatímco stabilita sekundárních je mnohem nižší a v roztocích byly pozorovány jen tři, izopropylový, s-butylový a cyklopentylový.[20] Neexistují téměř žádné náznaky pozorování primárních karbokationtů v roztocích, ani jako přechodných meziproduktů (objevily se náznaky pozorování ethylových kationtů při reakcích v 99,9% kyselině sírové a v FSO2OH·SbF5),[21] a methylový kation byl zaznamenán pouze v plynné fázi. Základní stavy primárních kationtů obsahují můstkové struktury s kladnými náboji rozprostřenými mezi dva nebo více atomů a tyto ionty bývají popisovány jako cyklopropany protonované z okrajů, ze stran nebo z rohů než jako skutečné primární kationty.[22][23] I jednoduchý ethylový kation, C2H +
5 , obsahuje tyto můstky a lze jej považovat za symetricky protonovanou molekulu ethenu; podobné je to i u vyšších homologů, jako jsou prop-1-ylový a but-1-ylový kation.[24] Neopentylové sloučeniny se ionizují za přesunu methylových skupin; samotné neopentylové ionty se tak, přinejmenším většinou, reakcí neúčastní.[25]
Stabilizaci alkylových skupin lze vysvětlit hyperkonjugací. Dodání elektronové hustoty z β C-H nebo C-C vazby do neobsazeného orbitalu p (interakce σCH/CC → p) umožní delokalizaci kladného náboje.
Na základě afinity hydridových iontů je vinylový kation méně stabilní i oproti primárnímu sp2-hybridizovanému karbokationtu, zatímco stabilita α alkylovaného vinylového iontu je s ním srovnatelná; vinylové ionty tak nejsou běžnými meziprodukty. Vytvořit se mohou ionizací vinylových elektrofilů, pokud je přítomna dobrá odstupující skupina (například TfO−, IPh nebo N2). Vyskytují se při některých vinylových substitucích (označovaných jako SN1(vinyl)ové reakce) a při elektrofilních adicích arylalkynů. Kromě základního vinylového kationtu, jenž pravděpodobně obsahuje můstky, a geometricky narušených cyklických vinyliontů je většina vinylových kationtů sp-hybridizovaných a lineárních.
Arylové kationty jsou méně stálé než vinylové, protože aromatický kruh způsobuje narušení lineární geometrie a sp2 povahy neobsazeného orbitalu. Pouze N2 u aryldiazoniových solí je dostatečně dobrou odstupující skupinou, aby mohla vytvářet arylové kationty.
Alkynylové katioty mají výrazně nižší stabilitu než CH +
3 (afinita hydridového iontu je 1620 kJ/mol oproti 1310 kJ/mol u CH +
3 ) a nelze je vytvořit čistě chemickými postupy; mohou vale vznikat radiochemicky s využitím beta přeměny tritia:[26]
- RC≡CT → [RC≡C3He]+ + e− + νe → RC≡C+ + 3He + e− + νe
Karbokationty mohou být atakovány nukleofily, například vodou, alkoholy, karboxyláty, azidy a halogenidy, čímž dochází k nukleofilním adicím. Silně zásadité nukleofily, zvláště ty se silnými sterickými efekty, vstupují snadněji do eliminačních reakcí než adicí. Protože s karbokationty reagují i slabé nukleofily, tak je obvykle lze přímo pozorovat či izolovat pouze v nenukleofilních prostředích, například superkyselinách.
Karbokationty se často přesmykují z méně stabilních na stabilnější přesunem alkylových skupin nebo vodíků na kationtová centra, která tak zanikají a vytváří se nová. Rychlostní konstanty těchto reakcí za pokojové teploty běžně převyšují 1010 s−1 a (z hlediska NMR) probíhají rychle i při −120 °C. V některých případech, jako je 2-norbornylový kation, mohou být přesuny vodíků dostatečně rychlé k interferencím s rentgenovou krystalografií i za 86 K (-187 °C).[27] Karbokationty se většinou přesmykují na terciární izomery, například všechny izomery C6H +
11 se mění na 1-methyl-1-cyklopentylový kation
Tyto přesmyky znesnadňují zkoumání reakčních mechanismů, například při zahřívání pentan-3-olu s kyselinou chlorovodíkovou se původně vzniklí 3-pentylový karbokation mění na statistickou směs 3-pentylového a 2-pentylového iontu. Tyto kationty poté reagují s chloridovými ionty za vzniku 3-chlorpentanu a 2-chlorpentanu v poměru přibližně 1:2. Tato skutečnost omezuje Friedelovy–Craftsovy alkylace a alkylareny se tak častěji připravují acylacemi následovanými Wolffovými–Kishnerovými nebo Clemmensenovými redukcemi.
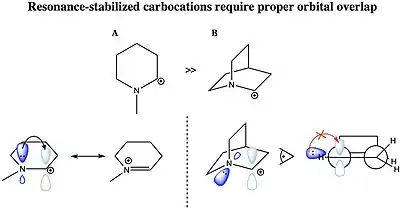
Karbokation může být stabilizován dvojnými vazbami C-C nebo volným párem heteroatomu v sousedství nabitého uhlíku. K rezonnančnímu stabilizování karbokationtu musí mít molekulový orbital dodávající skupiny vhodnou symetrii, orientaci a energii na interagování s prázdným 2p orbitalem tohoto karbokationtu. Příslušné kationty, například allylový (CH2=CH–CH +
2 a a benzylový kation (C6H5–CH +
2 jsou stabilnější než většina ostatních karbokationtů, protože se u nich objevuje dodávání elektronové hustoty z π systémů na kationtové centrum. Karbokationty aromatických sloučenin jsou navíc stabilizované delokalizací π elektronů na aromatických jádrech.[28] Molekuly schopné vytvářet allylové či benzylové karbokationty jsou tak velmi reaktivní. Kationty, kde se C+ vedle uhlíků s dvojnými nebo trojnými vazbami získávají další stabilitu překryvy prázdných p orbitalů karbokationtů s p orbitaly vazeb π. Tento překryv umožňuje rozptýlení kladného náboje a elektronové hustoty z π systému a její částečný přesun na centra s nedostatkem elektronů, což vede ke stabilizaci. Obzvláště stabilní jsou di- a tribenzylové karbokationty, difenylkarbenium a trifenylkarbenium (tritylový kation). Ze stejných důvodů částečná p povaha vazeb C–Cu cyklopropylových sloučenin stabilizuje cyklopropylmethylový (cyklopropylkarbinylový) kation.
V následující tabulce je zobrazena míra stability, vyjádřená afinitou hydridových iontů:
| Karbokation | C7H + 7 (nejstabilnější) |
(C6H5)3C+ | c-C3H + 3 |
(C6H5)2CH+ | 2-norbornyl+ | t-C4H + 9 |
C6H5CH + 2 |
i-C3H + 7 |
|---|---|---|---|---|---|---|---|---|
| Afinita (kJ/mol) | 842 | 900 | 925 | 930 | 967 | 967 | 980 | 1030 |
| Karbokation | c-C3H5CH + 2 |
CH2=CH–CH + 2 |
c-C5H + 5 |
CH≡C−CH + 2 |
C2H + 5 |
C2H + 3 |
C6H + 5 |
CH + 3 (nejméně stabilní) |
| Afinita (kJ/mol) | 1040 | 1070 | 1080 | 1130 | 1140 | 1200 | 1250 | 1310 |
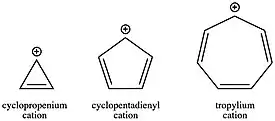
Tropyliový kation, C7H +
7 ) byl díky své aromatické stabilitě jedním z prvních objevených karbokationtů; je natolik stálý, že lze izolovat jeho soli. Na druhou stranu je antiaromatický cyklopentadienylový kation (C5H +
5 ) destabilizován přibližně o 170 kJ/mol. Cyklopropenový kation (C3H +
3 ), i přes destabilizaci úhlovým napětím, je díky aromativitě stále výrazně stabilnější než jeho necyklický analog, allylový kation. Tyto rozdíly ve stabilitě, dané počtem π elektronů v cyklech, mívají výrazný vliv na reakční kinetiku. Tvorba aromatických karbokationtů je mnohem rychlejší než u antiaromatických a acyklických. Na základě významu karbokationtů při reakcích, jako jsou [[[SN1 reakce|SN1 reakce]] lze tak volbou výchozích látek ovlivnit, které reakce budou výhodné a které nevýhodné, protože rychlostní konstanta závisí na aktivační energii podle Arrheniovy rovnice
.
Karbokationty mohou být výrazně stabilizovány hyperkonjugací, která může mít i stejný nebo dokonce větší vliv než konjugovaný π systém. I když konjugace nenasycených skupin vede k významné stabilizaci mezomerními efekty, tak tento jev mohou částečně narušit sp2 nebo sp uhlíky vedle karbokationtového centra. Na základě afinit hydridových iontů jsou tak sekundární karbokationty stabilizované více než allylové, zatímco terciární více než benzylové.
Oxokarbeniové a iminiové ionty mívají rezonanční struktury, ve kterých má uhlík kladný náboj a podle definice IUPAC se tak jedná o karbokationty, i když někdy nejsou považovány za „pravé“ karbokationty, protože jejich nejvýznamnější rezonanční struktury mají kladné náboje na atomech kyslíku či dusíku.
Neklasické ionty
Některé karbokationty, jako je 2-norbornylový mají více či méně symetrické tricentrické dvouelektronové vazby. Takové struktury, označované jako neklasické karbokationty, mají delokalizované vazby σ, čímž získávají vazby C–C a C–H zlomkové řády.[29] Tato delokalizace vede k další stabilizaci kationtu. Při zobrazení jako klasický karbeniový ion vypadá 2-norbornylový kation jako sekundární karbokation, je ale stálejší než běžné sekundární karbokationty, podobně jako jsou kationty terciární, například t-butylový.
Existence oneklasických karbokationtů byla předmětem sporů. Herbert Charles Brown se domníval, že to, co se jeví jako neklasické karbokationty, je ve skutečnosti průměr mezi dvěma rychle se vzájemně přeměňujícími klasickými strukturami nebo strukturami s určitým podílem můstků, která nicméně není symetrická a skutečná neklasická struktura je přechodným stavem mezi dvojicí stavů s nejmenšími potenciálními energiemi. Saul Winstein naproti tomu předpokládal, že neklasická struktura s rovinou symetrie je jedinou částicí s minimem potenciální energie a klasické struktury jsou pouze rezonanční struktury. Olahovo zjištění, že superkyseliny umožňují přímé pozorování karbokationtů, společně s velmi citlivou NMR technikou vyvinutou Martinem Saundersem, pomohlo rozřešit tento spor.[30][31] Přinejmenším u samotného 2-norbornylového kationtu byla podpořena Winsteinova domněnka, neobjevily se žádné známky vzájemného přeměňování klasických struktur, a to ani při teplotách okolo 6 K, a v roce 2013 bylo zjištěno, že jeho krystalová struktura je plně neklasická.[32][27] U řady karbokationtů (jako je ethylový) se nyní předpokládá, že mají neklasické struktury; v mnoha případech je ovšem rozdíl energií mezi dvěma možnými klasickými a neklasickou strukturou velmi malý a může být náročné je od sebe experimentálně rozlišit.
Příklady
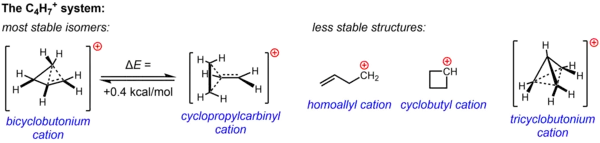
Neklasickou strukturu C4H +
7 podporuje množství experimentalních důkazů ze solvolytických experimentů a NMR studií v nenukleofilních prostředích. Jak jedna, tak i obě ze struktur, cyklopropylkarbinylový a bicyklobutoniový kation, přispívaly v různých experimentech k pozorované reaktivitě, zatímco údaje z NMR ukázaly značně proměnlivý systém prodělávající přesmyky na pozorované průměrné spektrum, které obsahuje pouze dva 13C-NMR signály, a to i za teploty −132 °C. Výpočetně bylo potvrzeno, že rozdělení energií u C4H +
7 je velmi ploché a oba izomery tak mají podobné energie, bicyklobutonium je jen o 2 kJ/mol stabilnější než cyklopropylkarbinylová struktura. V roztoku (SbF5·SO2ClF·SO2F2, s SbF –
6 jako protiiontem) bicyklobutonium nad cyklopropylkarbinylem při −61 °C převládá v poměru 84:16.
Tři další možné struktury, dvě klasické (homoallylový a cyklobutylový kation) a mnohem delokalizovanější neklasická struktura (tricyklobutoniový ion), jsou méně stabilní (cyklobutylový kation je spíše přechodným stavem než energetickým minimem).[33]
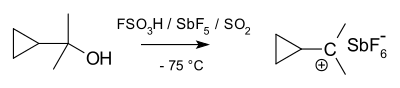
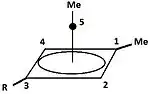
Substituované cyklopropylkarbinylové kationty byly také zkoumány NMR:[34][35]
V NMR spektru dimethylového derivátu se vyskytly dva neekvivalentní signály dvou methylových skupin, což naznačuje, že konformace tohoto iontu není kolmá (jako u A), s rovinou souměrnosti, ale je rozdělená (jako u B) s prázdným p-orbitalem rovnoběžně s cyklopropylovým kruhem:
Podle teorie banánové vazby lze tento stav vysvětlit výhodným překryvem orbitalů zaplněných vazeb cyklopropanu a prázdného p-orbitalu.[36]
Pyramidální karbokationty
| Pyramidální karbokationty | ||
|---|---|---|
 |
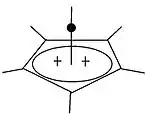 |
Kromě klasických a neklasických karbokationtů je také popsána třetí skupina, pyramidální karbokationty. U těchto iontů se jediný atom uhlíku nachází nad čtyřúhelníkem nebo pětiúhelníkem a vytváří tak strukturu ve tvaru jehlanu. Čtvercové pyramidální ionty mají náboj +1, pětiúhelníkové pyramidální ionty +2.
Byla také předpovězena stabilní šestiúhelníkově pyramidální struktura tropyliového trikationtu, (C7H7)3+.[37] V tomto případě má atom uhlíku koordinační číslo 7. Krystalová struktura [C6(CH3)6][SbF6]2·HSO3F má u hexamethylbenzenového dikationtu tvar pětibokého jehlanu.[38] |
| Příklad jednovazného karbokationtu | Příklad dvojvazného karbokationtu |
Související články
- Karboanion
- Karbeny
- Oxokarbenium
Reference
V tomto článku byl použit překlad textu z článku Carbocation na anglické Wikipedii.
- GRÜTZMACHER, Hansjörg; MARCHAND, Christina M. Heteroatom stabilized carbenium ions. Coordination Chemistry Reviews. 1997, s. 287–344. DOI 10.1016/S0010-8545(97)00043-X. (anglicky)
- Robert B. Grossman. The Art of Writing Reasonable Organic Reaction Mechanisms. [s.l.]: Springer Science & Business Media, 2007-07-31. Dostupné online. ISBN 978-0-387-95468-4. S. 105. (anglicky)
- OLAH, George A. Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions. Journal of the American Chemical Society. 1972, s. 808–820. DOI 10.1021/ja00758a020. (anglicky)
- SOMMER, J.; JOST, R. Carbenium and carbonium ions in liquid- and solid-superacid-catalyzed activation of small alkanes. Pure and Applied Chemistry. 2000-01-01, s. 2309–2318. ISSN 1365-3075. DOI 10.1351/pac200072122309. (anglicky)
- IUPAC Compendium of Chemical Terminology. [s.l.]: International Union of Applied Chemistry, 2009. ISBN 978-0967855097. DOI 10.1351/goldbook.C00817. Kapitola Carbocation. (anglicky)
- MCMURRY, John. Organic chemistry. 5th. vyd. [s.l.]: [s.n.] ISBN 978-0-534-37617-8. (anglicky)
- VOLLHARDT, K. Peter C.; SCHORE, Neil Eric. Organic chemistry: Structure and function. 8th. vyd. New York: [s.n.], 2018. ISBN 9781319079451. OCLC 1007924903 (anglicky)
- YURKANIS BRUICE, Paula. Organic Chemistry. 4th. vyd. [s.l.]: [s.n.], 2004. ISBN 978-0-13-140748-0. (anglicky)
- MERLING, G. Ueber Tropin. Berichte der Deutschen Chemischen Gesellschaft. 1891, s. 3108–3126. ISSN 0365-9496. DOI 10.1002/cber.189102402151. (anglicky)
- DOERING, W. von E.; KNOX, L. H. The Cycloheptatrienylium (Tropylium) Ion. Journal of the American Chemical Society. 1954, s. 3203–3206. DOI 10.1021/ja01641a027. (anglicky)
- Discovery of an in situ carbocationic system using trityl chloride as a homogeneous organocatalyst. Tetrahedron. 2013, s. 212–218. DOI 10.1016/j.tet.2012.10.042. (anglicky)
- On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives. American Chemical Journal. S. 101. ISSN 0096-4085. (anglicky)
- MEERWEIN, H.; EMSTER, K. van. About the equilibrium isomerism between bornyl chloride isobornyl chloride and camphene chlorohydrate. Berichte. 1922, s. 2500. (anglicky)
- RZEPA, H. S.; ALLAN, C. S. M. Racemization of Isobornyl Chloride via Carbocations: A Nonclassical Look at a Classic Mechanism. Journal of Chemical Education. 2010, s. 221. DOI 10.1021/ed800058c. Bibcode 2010JChEd..87..221R. (anglicky)
- DOERING, W. von E.; SAUNDERS, M.; BOYTON, H. G.; EARHART, H. W.; WADLEY, E. F.; EDWARDS, W. R.; LABER, G. The 1,1,2,3,4,5,6-heptamethylbenzenonium ion. Tetrahedron. 1958, s. 178–185. DOI 10.1016/0040-4020(58)88016-3. (anglicky)
- STORY, Paul R.; SAUNDERS, Martin. The 7-norbornadienyl carbonium ion. Journal of the American Chemical Society. 1960, s. 6199. DOI 10.1021/ja01508a058. (anglicky)
- SCHLEYER, Paul von R.; WATTS, William E.; FORT, Raymond C.; COMISAROW, Melvin B.; OLAH, George A. Stable Carbonium Ions. X.1 Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation. Journal of the American Chemical Society. 1964, s. 5679–5680. DOI 10.1021/ja01078a056. (anglicky)
- SAUNDERS, Martin; SCHLEYER, Paul von R.; OLAH, George A. Stable Carbonium Ions. XI.1 The Rate of Hydride Shifts in the 2-Norbornyl Cation. Journal of the American Chemical Society. 1964, s. 5680–5681. DOI 10.1021/ja01078a057. (anglicky)
- ANSLYN, Eric V.; DOUGHERTY, Dennis A. Modern Physical Organic Chemistry. Sausalito, CA: University Science Books, 2000. ISBN 978-1891389313. (anglicky)
- CARROLL, Felix A. Perspectives on structure and mechanism in organic chemistry. 2nd. vyd. Hoboken, N.J.: John Wiley, 2010. ISBN 9780470276105. (anglicky)
- OLAH, George A.; O'BRIEN, Daniel H.; WHITE, Anthony Mallinson. Stable carbonium ions. LII. Protonated esters and their cleavage in fluorosulfonic acid-antimony pentafluoride solution. Journal of the American Chemical Society. October 1967, s. 5694–5700. ISSN 0002-7863. DOI 10.1021/ja00998a036. (anglicky)
- CAREY, Francis A. Advanced organic chemistry. Sundberg, Richard J.. 5th. vyd. New York: Springer, 2007. ISBN 9780387448978. (anglicky)
- LOWRY, Thomas H. Mechanism and theory in organic chemistry. Richardson, Kathleen Schueller.. 3rd. vyd. New York: Harper & Row, 1987. Dostupné online. ISBN 0060440848. (anglicky)
- SCHULTZ, Jocelyn C.; HOULE, F. A.; BEAUCHAMP, J. L. Photoelectron spectroscopy of 1-propyl, 1-butyl, isobutyl, neopentyl, and 2-butyl radicals: free radical precursors to high-energy carbonium ion isomers. Journal of the American Chemical Society. July 1984, s. 3917–3927. ISSN 0002-7863. DOI 10.1021/ja00326a006. (anglicky)
- YAMATAKA, Hiroshi; ANDO, Takashi; NAGASE, Shigeru; HANAMURA, Mitsuyasu; MOROKUMA, Keiji. Ab initio MO calculations of isotope effects in model processes of neopentyl ester solvolysis. The Journal of Organic Chemistry. February 1984, s. 631–635. ISSN 0022-3263. DOI 10.1021/jo00178a010. (anglicky)
- ANGELINI, Giancarlo; HANACK, Michael; VERMEHREN, Jan; SPERANZA, Maurizio. Generation and trapping of an alkynyl cation. Journal of the American Chemical Society. 1988-02-17, s. 1298–1299. ISSN 0002-7863. DOI 10.1021/ja00212a052. (anglicky)
- SCHOLZ, F.; HIMMEL, D.; HEINEMANN, F. W.; SCHLEYER, P. v R.; MEYER, K.; KROSSING, I. Crystal Structure Determination of the Nonclassical 2-Norbornyl Cation. Science. 2013-07-05, s. 62–64. ISSN 0036-8075. DOI 10.1126/science.1238849. PMID 23828938. Bibcode 2013Sci...341...62S. (anglicky)
- AUE, Donald H. Carbocations. WIREs Computational Molecular Science. 2011, s. 487–508. Dostupné online. ISSN 1759-0884. DOI 10.1002/wcms.12. (anglicky)
- Hyperkonjugační stabilizace alkylovaných karbokationtů je v podstatě také druhem tricentrické dvouelektronové vazby. Vazby C–H zapojené do hyperkonjugace jsou tak mírně nakloněné ke karbokatiotovým centrům (protože se snižuje úhel vazeb +C–C–H bond). Atom vodíku je ovšem i tak primárně vázán na uhlík v poloze α vůči kationtovému uhlíku. Aby byl karbokation považován za neklasický, tak mnusí taková vazba obsahovat skupiny rovnocenně nebo téměř rovnocenně navázané na dvě centra s nedostatkem elektronů. Existuje spojitá řada možných vazebných schémat od zahrnutí sousední skupiny (slabé hyperkonjugace) po rovnocenné sdílení skupiny sousedními centry (plně neklasickou vazbu).
- OLAH, George A.; PRAKASH, G. K. Surya; SAUNDERS, Martin. Conclusion of the classical-nonclassical ion controversy based on the structural study of the 2-norbornyl cation. Accounts of Chemical Research. May 2002, s. 440–448. DOI 10.1021/ar00096a003. (anglicky)
- George A. Olah - Nobel Lecture
- YANNONI, C. S.; MYHRE, P. C.; WEBB, Gretchen G. Magic angle spinning nuclear magnetic resonance near liquid-helium temperatures. Variable-temperature CPMAS spectra of the 2-norbornyl cation to 6 K. Journal of the American Chemical Society. November 1990, s. 8991–8992. ISSN 0002-7863. DOI 10.1021/ja00180a060. (anglicky)
- OLAH, George A.; SURYA PRAKASH, G. K.; RASUL, Golam. Ab Initio/GIAO-CCSD(T) Study of Structures, Energies, and 13C NMR Chemical Shifts of C4H +
7 and C5H +
9 Ions: Relative Stability and Dynamic Aspects of the Cyclopropylcarbinyl vs Bicyclobutonium Ions. Journal of the American Chemical Society. July 2008, s. 9168–9172. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja802445s. (anglicky) - KABAKOFF, David S.; NAMANWORTH, Eli. Nuclear magnetic double resonance studies of the dimethylcyclopropylcarbinyl cation. Measurement of the rotation barrier. Journal of the American Chemical Society. 1970, s. 3234–3235. DOI 10.1021/ja00713a080. (anglicky)
- PITTMAN JR., Charles U.; OLAH, George A. Stable Carbonium Ions. XVII.1a Cyclopropyl Carbonium Ions and Protonated Cyclopropyl Ketones. Journal of the American Chemical Society. 1965, s. 5123–5132. DOI 10.1021/ja00950a026. (anglicky)
- CAREY, F. A.; SUNDBERG, R. J. Advanced Organic Chemistry Part A. 2nd. vyd. [s.l.]: [s.n.] (anglicky)
- WANG, George; RAHMAN, A. K. Fazlur; WANG, Bin. Ab initio calculations of ionic hydrocarbon compounds with heptacoordinate carbon. Journal of Molecular Modeling. May 2018, s. 116. ISSN 1610-2940. DOI 10.1007/s00894-018-3640-9. PMID 29696384. (anglicky)
- MALISCHEWSKI, Moritz; SEPPELT, K. Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3) 2+
6 . Angewandte Chemie International Edition. 2016-11-25, s. 368–370. ISSN 1433-7851. DOI 10.1002/anie.201608795. PMID 27885766. (anglicky)