Dusičnany
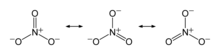
Dusičnany (též ledky, nitráty) jsou soli kyseliny dusičné, často využívané v zemědělství na výrobu hnojiv (pro přítomnost dusíku) a v pyrotechnice (protože jde o oxidační činidla) např. pro výrobu střelného prachu. Základem dusičnanů je aniont NO3− o molární hmotnosti 62,01 g/mol.
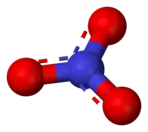
Dusičnany se vyskytují i v přírodě v podobě několika nerostů, avšak jejich těžba by nebyla schopna pokrýt celosvětovou spotřebu, proto se vyrábějí uměle. Jsou přítomny i v mořské vodě, kde jejich nadměrné zastoupení umožňuje život fytoplanktonu (například v oblasti Aljašky); nadměrné zastoupení dusičnanů ve sladké vodě (zejména jezerech) naopak způsobuje množení řas a sinic. Téměř všechny dusičnany jsou ve vodě dobře rozpustné.
Přírodní koloběh dusíku
Rozkladem bílkovin a jiných dusíkatých sloučenin vzniká amoniak. Působením nitrifikačních bakterií dochází k jeho přeměně na dusitany, které se dále oxidují na dusičnany. Anorganické sloučeniny dusíku obsažené v půdě se stávají součástí rostlinných potravin.[1] Do živočišných se dostávají z krmiva nebo záměrným přidáváním dusitanových a dusičnanových solí plnící funkci konzervace a stabilizace barvy masa.[2]
Obsah dusičnanů
Mezi hlavní potravinové zdroje dusičnanů řadíme brambory, zeleninu a pitnou vodu. Vysoký obsah dusičnanů (nad 1000 mg/kg) se vyskytuje především v salátu, špenátu, endivii, ředkvičce, celeru, reveni a kukuřici, středně vysoký obsah mají brambory, brokolice, petržel, mrkev, lilek, květák, zelí, kapusta a česnek. Nízký obsah (pod 250 mg/kg) obsahují okurky, rajčata, hrách, cibule a růžičková kapusta. Významné zastoupení dusičnanů v ovoci mají zejména banány, melouny a jahody.[3]
Hlavní zástupci přídatných látek jsou dusičnan sodný (E 251) a dusičnan draselný (E 252)[1][4]
Toxicita
Pro dospělé osoby nejsou dusičnany v obvyklých koncentracích nebezpečné, jsou téměř netoxické, neboť se docela rychle dostávají z organismu močí. Otrava vzniká v případě požití extrémní dávky. Mezi příznaky dusičnanové intoxikace patří žízeň, průjmy, koliky, excitace a křeče přítomné do 3 až 7 hodin po expozici. Činností bakterií v gastrointestinálním traktu může docházet k nepřímé toxicitě dusičnanů. Tyto bakterie snadno redukují dusičnany na dusitany, které svojí toxicitou vyvolávají vlastní otravu. Nejvyšší přípustná dávka je asi 3,5 mg/kg tělesné hmotnosti (kolem 245 mg). Evropský úřad pro bezpečnost potravin (EFSA) v červnu 2017 stanovil přijatelný denní příjem dusičnanů na 3,7 miligramu na kilogram tělesné hmotnosti a den.
Mezi další potíže způsobené příjmem dusičnanů se řadí inhibice růstového faktoru na úrovni hypothalamu a interference s metabolismem vitaminů A a E. Kompetitivní snížením příjmu jódu může způsobovat případný strumigenní účinek.[5]
Redukcí dusičnanů ve slinách mohou vznikat dusitany. Prostřednictví reakce nitrosace mohou za určitých podmínek reagovat dusitany s aminokyselinami za vzniku nitrosaminů. Vztah mezi příjmem dusičnanů a tvorbou NOC (N-nitrosloučeniny) podporuje několik studií.[6] Doposud však nebyly předloženy přímé důkazy o souvislosti dusičnanů s karcinogenními účinky. V roce 2003 FAO/WHO Expert Committee on Food Additives prohlásil, že epidemiologické studie neprokázaly zvýšené riziko rakoviny s rostoucí spotřebou dusičnanů.
Dusičnany v pitné vodě

Česká norma pro pitnou vodu uvádí pro obsah dusičnanů maximální povolené množství pro dospělého 50 mg/l, pro dítě 15 mg/l. V českých veřejných vodovodech se běžně vyskytuje 30 až 40 mg/l dusičnanů, individuální zdroje vody mívají obsah dusičnanů často i několikanásobně vyšší. Odstranit dusičnany běžnými mechanickými nebo uhlíkovými filtry na vodu není možné, je nutné použít speciální denitratační anex.
Význam dusičnanů v lidské stravě
Navzdory výše zmiňovaným negativním efektům dusičnanů na zdraví přibývají důkazy o jejich zdravotní prospěšnosti. Redukcí dusitanů a dusičnanů ve formě nitritu, respektive nitrátu vzniká oxid dusnatý (NO). Ten ovlivňuje krevní tlak a cévní homeostázu. Přibývají důkazy o tom, že biologickou aktivitu NO mohou zlepšit dusičnany a dusitany. Tento jev způsobí vazodilataci, inhibici krevních destiček a tím se dusičnany a dusitany podílejí na kardiovaskulárním zdraví[7]. Na základě výsledků několika studií vyplývá, že požití dusičnanů snižuje krevní tlak, a to u zdravých i hypertenzních pacientů[8].
Další potenciální skupinou využívající výhod působení dusičnanů, respektive dusitanů na dilataci cév jsou sportovci nebo lidé s vyšším fyzickým výkonem.
Vzhledem k těmto působením na kardiovaskulární systém příjem dusičnanů v přiměřeném množství přináší zdravotní benefity. Bohatým zdrojem těchto látek je mimo jiné zelenina. Jejich množství kolísá a je ovlivněno klimatickými podmínkami, obecně jsou ale dobrým zdrojem dusičnanů v rámci zeleniny salát, ředkvičky, špenát, celer a cukrová kukuřice. Konzumace těchto plodin přispívá k prevenci kardiovaskulárních onemocnění a zlepšuje celkovou kondici kardiovaskulárního systému[9].
Dělení dusičnanů
Dusičnany alkalických kovů
Do této skupiny náleží dusičnan lithný (), dusičnan sodný (NaNO3), dusičnan draselný (KNO3), dusičnan rubidný (), dusičnan cesný () a dusičnan francný ().
Tyto dusičnany jsou bílé, krystalické látky, rozpustné ve vodě. Lze je připravit reakcí kyseliny dusičné s příslušným hydroxidem. Při zahřívání se rozpadají na dusitan a kyslík, dle reakce (Me označuje prvek alkalického kovu):
- 2 MeNO3 —t→ 2 MeNO2 + O2
Díky vzniklému kyslíku jsou tyto dusičnany dobrými oxidačními činidly. Tyto látky mají velký průmyslový význam.
Dusičnany kovů alkalických zemin
Do této skupiny náleží dusičnan berylnatý (), dusičnan hořečnatý (), dusičnan vápenatý (Ca(NO3)2), dusičnan strontnatý (Sr(NO3)2)), dusičnan barnatý () a dusičnan radnatý ().
Tyto ve vodě rozpustné látky při zahřívání tvoří oxid kovu a oxid dusičitý:
- MeNO3 —t→ MeO + NO2
Tyto látky mají své uplatnění obvykle v pyrotechnice, skoro vůbec se neužívají jako hnojiva.
Dusičnany přechodných kovů
Do této skupiny náleží dusičnan stříbrný (AgNO3), dusičnan měďnatý (Cu(NO3)2) a dusičnan olovnatý (Pb(NO3)2).
Tyto ve vodě rozpustné látky při zahřívání tvoří oxid kovu a oxid dusičitý:
- MeNO3 —t→ MeO + NO2
Tyto látky se neužívají obvykle jako pyrotechnika ani hnojiva. Často se užívají v chemii na další syntézy.
Dusičnany s nekovovými kationty
Do této skupiny náleží např. dusičnan amonný (NH4NO3).
Tyto dusičnany mají místo atomu kovu v molekule jiný prvek či skupinu látek. Vlastnosti jsou pro každý dusičnan individuální.
Organické dusičnany
Do této skupiny náleží nitroglycerin či nitrocelulóza.
Kyselina dusičná je schopna reagovat s alkoholy za vzniku esterů. Tyto látky mají na molekule navázánu skupinu NO3−, která se označuje předponou nitroxy, ale je běžné se setkat s nitro. Některé mají průmyslový význam, část má význam jako trhaviny a některé jsou důležitými biochemickými látkami.
Část z nich lze vyrobit reakcí organické sloučeniny s kyselinou dusičnou za přítomnosti kyseliny sírové nebo fosforečné (nelze tak připravit zejména 1,3,5-cyklotrimethylentrinitramin, jelikož reaguje s kyselinou sírovou i fosforečnou. Jako alternativa se v tomto případě užívá dusičnan amonný.)
Zde je několik příkladů nitrátů:
Galerie
 Dusičnan zinečnatý Zn(NO3)2
Dusičnan zinečnatý Zn(NO3)2 Dusičnan vápenatý Ca(NO3)2
Dusičnan vápenatý Ca(NO3)2 Dusičnan stříbrný AgNO3 (Je patrná přítomnost stříbra na povrchu)
Dusičnan stříbrný AgNO3 (Je patrná přítomnost stříbra na povrchu) Dusičnan sodný NaNO3
Dusičnan sodný NaNO3 Dusičnan olovnatý Pb(NO3)2
Dusičnan olovnatý Pb(NO3)2 Dusičnan kobaltnatý Co(NO3)2
Dusičnan kobaltnatý Co(NO3)2 Dusičnan kademnatý Cd(NO3)2
Dusičnan kademnatý Cd(NO3)2 Dusičnan hořečnatý Mg(NO3)2
Dusičnan hořečnatý Mg(NO3)2 Dusičnan hlinitý Al(NO3)3
Dusičnan hlinitý Al(NO3)3 Dusičnan draselný KNO3
Dusičnan draselný KNO3 Dusičnan bismutitý Bi(NO3)3
Dusičnan bismutitý Bi(NO3)3 Dusičnan barnatý Ba(NO3)2
Dusičnan barnatý Ba(NO3)2 Dusičnan manganatý Mn(NO3)2
Dusičnan manganatý Mn(NO3)2 Dusičnan amonný NH4NO3
Dusičnan amonný NH4NO32.png.webp) Dusičnan strontnatý Sr(NO3)2
Dusičnan strontnatý Sr(NO3)2
Seznam (výběr)
- Dusičnan aktinitý
- Dusičnan amonný
- Dusičnan barnatý
- Dusičnan berylnatý
- Dusičnan bismutitý
- Dusičnan ceritý
- Dusičnan cesný
- Dusičnan draselný
- Dusičnan močoviny
- Dusičnan-oxid bismutitý
- Dusičnan dysprositý
- Dusičnan europitý
- Dusičnan gadolinitý
- Dusičnan gallitý
- Dusičnan hlinitý
- Dusičnan holmitý
- Dusičnan hořečnatý
- Dusičnan hydrazinu
- Dusičnan hydroxylamonný
- Dusičnan chlorný
- Dusičnan chromitý
- Dusičnan kademnatý
- Dusičnan kalifornitý
- Dusičnan kobaltitý
- Dusičnan kobaltnatý
- Dusičnan lithný
- Dusičnan manganatý
- Dusičnan měďnatý
- Dusičnan močoviny
- Dusičnan neodymitý
- Dusičnan nikelnatý
- Dusičnan olovnatý
- Dusičnan palladnatý
- Dusičnan plutoničitý
- Dusičnan rhoditý
- Dusičnan rtuťnatý
- Dusičnan rtuťný
- Dusičnan rubidný
- Dusičnan skanditý
- Dusičnan sodný
- Dusičnan strontnatý
- Dusičnan stříbrný
- Dusičnan terbitý
- Dusičnan tetraamminměďnatý
- Dusičnan thallitý
- Dusičnan thoričitý
- Dusičnan thulitý
- Dusičnan titaničitý
- Dusičnan uranylu
- Dusičnan vápenatý
- Dusičnan yttritý
- Dusičnan zinečnatý
- Dusičnan zirkoničitý
- Dusičnan železitý
Odkazy
Reference
- DUSIČNANY A DUSITANY - Documents. Documents.tips. Dostupné online [cit. 2016-12-08].
- Obecná hygiena potravin. [s.l.]: Mendelova zemědělská a lesnická univerzita OCLC 56871275
- Bezpečnost potravin A-Z. www.bezpecnostpotravin.cz [online]. [cit. 2016-12-08]. Dostupné online.
- Miroslav Šuta, Vladimír Šťovíček: Dusičnany a dusitany v potravinách. Je důvod k obavám?, Český rozhlas Plzeň, Zdraví "v cajku", 25. srpna 2017
- Hodnocení zdravotního rizika dusičnanů a dusitanů z pitné vody. Informační Centrum Bezpečnosti Potravin.cz. Dostupné online [cit. 2016-12-10]. (česky)
- HLOBILOVÁ, Veronika. Dusitany a dusičnany ve stravě - jejich negativa a pozitiva [online]. [cit. 2016-12-10]. Dostupné online.
- MACHHA, Ajay; SCHECHTER, Alan N. Dietary nitrite and nitrate: a review of potential mechanisms of cardiovascular benefits. European Journal of Nutrition. 2011-05-31, roč. 50, čís. 5, s. 293–303. Dostupné online [cit. 2016-12-10]. ISSN 1436-6207. DOI 10.1007/s00394-011-0192-5. PMID 21626413. (anglicky)
- LARSEN, Filip J.; EKBLOM, Björn; SAHLIN, Kent. Effects of Dietary Nitrate on Blood Pressure in Healthy Volunteers. New England Journal of Medicine. 2006-12-28, roč. 355, čís. 26, s. 2792–2793. PMID 17192551. Dostupné online [cit. 2016-12-10]. ISSN 0028-4793. DOI 10.1056/NEJMc062800. PMID 17192551.
- BAILEY, Stephen J.; FULFORD, Jonathan; VANHATALO, Anni. Dietary nitrate supplementation enhances muscle contractile efficiency during knee-extensor exercise in humans. Journal of Applied Physiology. 2010-07-01, roč. 109, čís. 1, s. 135–148. PMID 20466802. Dostupné online [cit. 2016-12-10]. ISSN 8750-7587. DOI 10.1152/japplphysiol.00046.2010. PMID 20466802. (anglicky)