Dusičnan zinečnatý
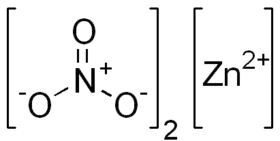
Dusičnan zinečnatý je anorganická sloučenina s chemickým vzorcem Zn(NO3)2. Tato bílá krystalická látka se obvykle vyskytuje jako hexahydrát . Je rozpustná ve vodě i alkoholu.
| Dusičnan zinečnatý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Dusičnan zinečnatý |
| Anglický název | Zinc nitrate |
| Sumární vzorec | Zn(NO3)2 |
| Vzhled | bezbarvé, rozplývavé krystaly |
| Identifikace | |
| Registrační číslo CAS | 7779-88-6 |
| PubChem | 24518 |
| Vlastnosti | |
| Molární hmotnost | 189,36 g / mol (bezvodý)
297,49 g / mol (hexahydrát) |
| Teplota tání | 110 °C |
| Teplota varu | 125 °C |
| Hustota | 2,065 g/cm3 (hexahydrát) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Syntéza a reakce
Dusičnan zinečnatý se obvykle připravuje rozpuštěním zinku v kyselině dusičné, průběh reakce je závislý na koncentraci kyseliny, přičemž reakce v koncentrované kyselině také vytváří dusičnan amonný:
(HNO3 zředěná)
(HNO3 koncentrovaná)
Při zahřívání podléhá tepelnému rozkladu za vzniku oxidu zinečnatého, oxidu dusičitého a kyslíku.
Aplikace
Dusičnan zinečnatý nemá aplikace ve velkém měřítku, ale používá se v laboratorním měřítku pro syntézu koordinačních polymerů.[2] Jeho řízený rozklad na oxid zinečnatý byl také použit pro generování různých struktur na bázi ZnO, včetně nanovláken.[3]
Může být použit jako mořidlo při barvení. Příkladem reakce je srážení uhličitanu zinečnatého:
Reference
V tomto článku byl použit překlad textu z článku Zinc nitrate na anglické Wikipedii.
- Zinc nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Barnett, Sarah A; Champness, Neil R (Listopad 2003). "Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands". Coordination Chemistry Reviews. 246 (1–2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (Září 2006). "Solution-Grown Zinc Oxide Nanowires". Inorganic Chemistry. 45 (19): 7535–7543. doi:10.1021/ic0601900.
Externí odkazy
 Obrázky, zvuky či videa k tématu Dusičnan zinečnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dusičnan zinečnatý na Wikimedia Commons



