Dusičnan nikelnatý
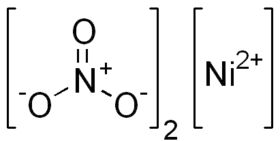
Dusičnan nikelnatý je anorganická sloučenina s chemickým vzorcem Ni(NO3)2. Bezvodá forma dusičnanu nikelnatého se běžně nevyskytuje, běžnější je hexahydrát.
| Dusičnan nikelnatý | |
|---|---|
 | |
2_hexahydrate_edit.jpg.webp)
hexahydrát | |
| Obecné | |
| Systematický název | Dusičnan nikelnatý |
| Anglický název | Nickel(II) nitrate |
| Německý název | Nickel(II)-nitrat |
| Sumární vzorec | Ni(NO3)2 |
| Vzhled | smaragdově zelená hygroskopická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13138-45-9 |
| 13478-00-7 (hexahydrát) | |
| Číslo EC (enzymy) | 238-076-4 |
| PubChem | 25736 |
| SMILES | [Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI | InChI=1S/2NO3.Ni/c2*2-1(3)4;/q2*-1;+2
Key: KBJMLQFLOWQJNF-UHFFFAOYSA-N InChI=1/2NO3.Ni/c2*2-1(3)4;/q2*-1;+2 Key: KBJMLQFLOWQJNF-UHFFFAOYAP |
| Vlastnosti | |
| Molární hmotnost | 182,703 g/mol (bezvodý)
290,79 g/mol (hexahydrát) |
| Teplota tání | 56,7 °C (134,1 °F; 329,8 K) (hexahydrát) |
| Teplota varu | 136,7 °C (278,1 °F; 409,8 K) (hexahydrát) |
| Hustota | 2,05 g/cm3 (hexahydrát) |
| Rozpustnost ve vodě | 243 g/100 ml (0 °C) (hexahydrát) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R49 R61 R8 R20/22 R38 R41 R42/43 R48/23 R68 R50/53 |
| S-věty | S53 S45 S60 S61 |
| NFPA 704 |  0
2
0
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Hexahydrát dusičnanu nikelnatého se připravuje reakcí oxidu nikelnatého s kyselinou dusičnou:
Bezvodý dusičnan nikelnatý se obvykle nepřipravuje zahříváním hydrátů. Spíše se připravuje reakcí uhličitanu nikelnatého s oxidem dusičitým:[2]
Vlastnosti
Dusičnan nikelnatý je silné oxidační činidlo a vyskytuje se v různých formách hydrátů. Nejběžnější je hexahydrát . Když je hexahydrát pomalu zahříván, tvoří se tetrahydrát , a od 45 °C se tvoří dihydrát . Základní dusičnan nikelnatý se tvoří při 120 až 145 °C. Nonahydrát se může tvořit při chlazení . Při teplotě nad 200 °C začíná dusičnan nikelnatý vytvářet oxid nikelnatý. Rychlé zahřívání způsobuje rozklad mezi 310 a 340 °C na oxid nikelnatý, oxidy dusíku a kyslík.
Využití
Dusičnan nikelnatý se používá v keramickém průmyslu (jako hnědý pigment), v barvicím průmyslu jako mořicí činidlo, pro elektrolytické pokovování niklem, pro extrakci oxidu nikelnatého a pro výrobu čistého katalyzátoru niklu.
Bezpečnost
Jako jiné dusičnany je dusičnan nikelnatý oxidační činidlo. Dráždí oči, pokožku,při vdechování prachu dýchací cesty. Může způsobit kožní alergii. Dusičnan nikelnatý je karcinogen, stejně jako většina ostatních sloučenin niklu. Iont niklu je také toxický pro vodní organismy.
Reference
- Nickel nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Keith Lascelles, Lindsay G. Morgan, David Nicholls, Detmar Beyersmann, "Nickel Compounds" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a17_235.pub2
Externí odkazy
 Obrázky, zvuky či videa k tématu Dusičnan nikelnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dusičnan nikelnatý na Wikimedia Commons
V tomto článku byly použity překlady textů z článků Nickel(II) nitrate na anglické Wikipedii a Nickel(II)-nitrat na německé Wikipedii.




