Dusičnan kobaltnatý
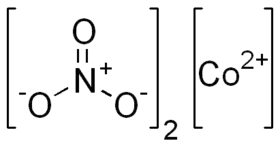
Dusičnan kobaltnatý je anorganická sloučenina s chemickým vzorcem Co(NO3)2.[2] Je to sůl kyseliny dusičné a kobaltu. Jeho nejběžnější formou je hexahydrát Co(NO3)2·6H2O, což je červeno-hnědá sůl rozpustná ve vodě a jiných nepolárních rozpouštědlech.[3]
| Dusičnan kobaltnatý | |
|---|---|
 | |
-nitrate-hexahydrate-sample.jpg.webp) | |
| Obecné | |
| Systematický název | dusičnan kobaltnatý |
| Anglický název | Cobalt(II) nitrate |
| Německý název | Cobalt(II)-nitrat |
| Sumární vzorec | Co(NO3)2 |
| Vzhled | světle červený prášek (bezvodý)
červená krystalická látka (hexahydrát) |
| Identifikace | |
| Registrační číslo CAS | 10141-05-6 |
| Číslo EC (enzymy) | 233-402-1 |
| PubChem | 25000 |
| ChEBI | CHEBI:86209 |
| UN kód | 1477 |
| SMILES | [Co+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Číslo RTECS | GG1109000 |
| Vlastnosti | |
| Molární hmotnost | 182,943 g/mol (bezvodý)
291,03 g/mol (hexahydrát) |
| Teplota tání | 100 °C rozkládá se (bezvodý)
55 °C (hexahydrát) |
| Teplota varu | 100–105 °C rozkládá se (bezvodý)
74 °C (hexahydrát) |
| Hustota | 2.49 g/cm3 (bezvodý)
1.87 g/cm3 (hexahydrát) |
| Rozpustnost ve vodě | bezvodý: 84.03 g/100 ml (0 °C)
334.9 g/100 ml (90 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H317 H334 H341 H350 H360 H400 H410 |
| P-věty | P201 P202 P261 P272 P273 P280 P281 P285 P302+352 P304+341 P308+313 P321 P333+313 P342+311 P363 P391 P405 P501 |
| NFPA 704 |  0
2
0
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Složení a struktura
Existuje několik hydrátů dusičnanu kobaltnatého. Tyto hydráty mají vzorec Co(NO3)2·nH2O kde n může být 0, 2, 4, 6.
-nitrate-xtal-2002-CM-3D-SF.png.webp) |
-nitrate-dihydrate-xtal-1976-CM-3D-balls.png.webp) |
-nitrate-tetrahydrate-xtal-1975-CM-3D-balls.png.webp) |
-nitrate-xtal-1973-unit-cell-CM-3D-balls.png.webp) |
|---|---|---|---|
Využití
Obvykle se redukuje na kovový kobalt o vysoké čistotě.[3] Může být absorbován na různých nosičích katalyzátoru pro použití při Fischer-Tropschově katalýze.[4] Používá se při přípravě barviv a inkoustů.[5]
Výroba
Hexahydrát se připravuje působením kyseliny dusičné na kovový kobalt nebo jeho oxidy, hydroxidy, či uhličitany:
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Cobalt(II) nitrate na anglické Wikipedii.
- Cobalt nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- http://www.ilo.org/dyn/icsc/showcard.display?p_card_id=1397&p_edit=&p_version=2&p_lang=en načteno 23.7.2020 (anglicky)
- John Dallas Donaldson, Detmar Beyersmann, "Cobalt and Cobalt Compounds" v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a07_281.pub2
- Ernst B, Libs S, Chaumette P, Kiennemann A. Appl. Catal. A 186 (1-2): 1451681999
- Lewis, Richard J., Sr. (2002). Hawley's Condensed Chemical Dictionary (14th Edition). John Wiley & Sons. http://www.knovel.com/knovel2/Toc.jsp?BookID=704&VerticalID=0
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Dusičnan kobaltnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dusičnan kobaltnatý na Wikimedia Commons


