Izotopy vodíku
Vodík (H) má tři přírodní izotopy označované 1H, 2H a 3H. První dva jsou stabilní, 3H má poločas přeměny 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10−21 s). Z nich je nejstabilnější 5H a nejméně stabilní 7H.[1][2]
Vodík je jediný prvek, jehož izotopy mají „triviální“ názvy, které jsou stále běžně používány. 2H je často nazýván deuterium nebo těžký vodík a 3H má pojmenování tritium nebo velmi těžký vodík. Nejjednodušší izotop vodíku, který nemá v jádru neutrony, se nazývá protium.
Vodík-1 (protium)
1H (hmotnost atomu 1,007 825 04(7) u) je nejběžnější izotop vodíku, zaujímá více než 99,98 % vodíkových atomů v přírodě. Protože se jeho jádro skládá pouze z protonu, nazývá se také protium.
Rozpad protonu nebyl nikdy pozorován a vodík-1 je tedy považován za stabilní nuklid. Podle některých teorií velkého sjednocení navržených v 70. letech 20 století by se měl rozpadat s poločasem 1031 až 1036 let. Pokud je tato předpověď pravdivá, pak by byl vodík-1 (a všechna další atomová jádra) pouze pozorovatelně stabilní.
Vodík-2 (deuterium)
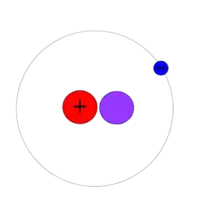
2H (hmotnost atomu 2,013 553 212 724(78) u), další stabilní izotop, je známý jako deuterium a v jádru má jeden proton a jeden neutron. Jádro deuteria se nazývá deuteron. Deuterium zaujímá 0,002 6 až 0,018 4 procent přírodního vodíku (podle počtu atomů), největší výskyt bývá obvykle v mořské vodě. Toto zastoupení je větší, než je ve vesmíru obvyklé (kolem 27 ppm). Jeho vyšší koncentrace ve vnitřní sluneční soustavě je způsobena nižší těkavostí 2H a jeho sloučenin oproti 1H; kvůli vyšší molární hmotnosti se totiž pomaleji vypařovaly působením slunečního záření.
Pro tento izotop se někdy používá chemická značka D.
Deuterium není radioaktivní ani toxické. Voda obohacená o molekuly s deuteriem místo protia se nazývá těžká voda (D2O). Existuje rovněž polotěžká voda (HDO), jejíž molekula má deuteriem nahrazený jen jeden atom protia. Sloučeniny deuteria se používají jako rozpouštědla v NMR spektroskopii. Těžká voda slouží jako moderátor neutronů a chladivo jaderných reaktorů. Deuterium je také možným zdrojem energie v komerční jaderné fúzi.
Vodík-3 (tritium)
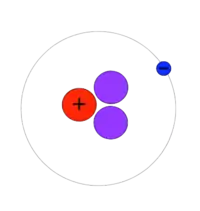
3H (hmotnost atomu 3,016 049 2 u) se také nazývá tritium a v jeho jádru (nazývaném triton) se nachází proton a dva neutrony. Někdy se pro něj používá značka T. Je radioaktivní, podléhá beta minus přeměně s poločasem 12,32 let.[3]
V malém množství se vyskytuje v přírodě, neboť vzniká reakcí kosmického záření s plyny v atmosféře. Tritium bylo rovněž uvolněno při testech jaderných zbraní. Použití nalézá v izotopové geochemii, termonukleárních zbraních a jako trvalý zdroj světla. S kyslíkem vytváří tritiovou (supertěžkou) vodu.
Nejčastěji se tritium vyrábí z přírodního izotopu lithia, lithia-6 reakcí s neutrony v jaderném reaktoru.
V deuterium-tritiové fúzi se tritium společně s deuteriem využívá k získávání energie skrz úbytek hmotnosti při srážce a následné fúzi za vysoké teploty.
Vodík-4
| Vodík-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Vodík-4, H, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Nekovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 4,027 81(11) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4H (hmotnost atomu 4,026 43(11) u) má v jádru tři neutrony. Jedná se o velmi nestabilní umělý radioizotop, který byl připraven v laboratoři bombardováním tritia rychlými jádry deuteria (pomalá jádra by se sloučila na rovněž velmi nestabilní 5He).[4] V tomto experimentu tritiové jádro zachytilo neutron z rychlého deuteronu. Přítomnost vodíku-4 byla odvozena z detekce zbylého protonu.[5]
Jde o nejlehčí z tzv. těžkých izotopů vodíku, tedy s neutronovým číslem vyšším než 2.
4H se rozpadá vyzářením neutronu za vzniku tritia, s poločasem přeměny 1,39±0,10×10−22 s.[6]
3
1 H + 2
1 H → 4
1 H + 1
1 H
Vodík-5
| Vodík-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Vodík-5, H, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Nekovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 5,035 31(11) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5H je vysoce nestabilní umělý radioizotop vodíku, jeho jádro obsahuje 4 neutrony. Byl připraven v laboratoři bombardováním tritia rychlými jádry tritia.[4][7] V tomto experimentu tritiové jádro zachytilo dva neutrony z rychlého tritonu a stává se jádrem s jedním protonem a čtyřmi neutrony. Přítomnost vodíku-5 byla odvozena z detekce zbylého protonu.
Jde o jeden z tzv. těžkých izotopů vodíku, tedy s neutronovým číslem vyšším než 2.
5H se rozpadá dvojitým vyzářením neutronu za vzniku tritia, s poločasem přeměny nejméně 9,1×10−22 s.[6]
2 3
1 H → 5
1 H + 1
1 H.
Vodík-6
| Vodík-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Vodík-6, H, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Nekovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 6,04494(28) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6H je umělý radioizotop vodíku, který se rozpadá trojitým vyzářením neutronu na tritium nebo čtyřnásobným na deuterium s poločasem přeměny 2,9×10−22 s.[6]
Jde o jeden z tzv. těžkých izotopů vodíku, tedy s neutronovým číslem vyšším než 2.
Vodík-7
| Vodík-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Vodík-7, H, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Nekovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 7,05275(108) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7H je umělý radioizotop vodíku, který se skládá z protonu a šesti neutronů. Poprvé byl syntetizován roku 2003 skupinou ruských, japonských a francouzských vědců v laboratořích RIKEN bombardováním vodíku atomy helia-8, kdy všech 6 neutronů bylo předáno vodíku.[2]
Vodík-7 se rozpadá s poločasem přeměny 2,3×10−23 s.[6]
Jde o jeden z tzv. těžkých izotopů vodíku, tedy s neutronovým číslem vyšším než 2.
Rozpadové řady
Většina radioizotopů vodíku se přeměňuje přímo na tritium, jež se následně mění na stabilní helium-3.
Poločas přeměny 3H je vyjádřen v rocích, u ostatních izotopů v yoctosekundách (10−24 s).
Reference
V tomto článku byl použit překlad textu z článku Isotopes of hydrogen na anglické Wikipedii.
- Y. B. Gurov. Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei. 2004, s. 491–497. DOI 10.1134/1.1891200. Bibcode 2005PAN....68..491G. (anglicky)
- A. A. Korsheninnikov. Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Physical Review Letters. 2003, s. 082501. DOI 10.1103/PhysRevLett.90.082501. Bibcode 2003PhRvL..90h2501K. (anglicky)
- G. L. Miessler; D. A. TARR. Inorganic Chemistry. 3rd. vyd. [s.l.]: Pearson Prentice Hall, 2004. Dostupné online. ISBN 978-0-13-035471-6. (anglicky)
- G. M. Ter-Akopian. Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam. AIP Conference Proceedings. 2002, s. 920. DOI 10.1063/1.1470062. (anglicky)
- M. Wang; G. AUDI; A. H. WAPSTRA; F. G. KONDEV; M. MACCORMICK; X. XU; B. PFEIFFER. The Ame2012 atomic mass evaluation (II). Tables, graphs, and references. Chinese Physics C. 2012, s. 7. Dostupné v archivu pořízeném dne 2017-02-14. DOI 10.1088/1674-1137/36/12/003. (anglicky) Archivovaná kopie. amdc.impcas.ac.cn [online]. [cit. 2017-02-26]. Dostupné v archivu pořízeném z originálu dne 2017-02-14.
- G. Audi; A. H. WAPSTRA; C. THIBAULT; J. BLACHOT; O. BERSILLON. The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A. 2003, s. 3–128. Dostupné v archivu pořízeném dne 2011-07-20. DOI 10.1016/j.nuclphysa.2003.11.001. Bibcode 2003NuPhA.729....3A. (anglicky) Archivovaná kopie. amdc.in2p3.fr [online]. [cit. 2017-02-26]. Dostupné v archivu pořízeném z originálu dne 2011-07-20.
- A. A. Korsheninnikov. Superheavy Hydrogen 5H. Physical Review Letters. 2001, s. 92501. DOI 10.1103/PhysRevLett.87.092501. Bibcode 2001PhRvL..87i2501K. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu izotopy vodíku na Wikimedia Commons
Obrázky, zvuky či videa k tématu izotopy vodíku na Wikimedia Commons