Koordinační chemie
Komplexní neboli koordinační chemie je obor chemie zabývající se komplexními (koordinačními) sloučeninami - komplexy. Ačkoliv neexistuje jednoznačná definice komplexů, tak se v základním pojetí považuje za komplex částice, která obsahuje centrální atom (Lewisovou kyselinou) a na něj komplexně vázané ligandy (Lewisovy báze). Komplexní částice většinou obsahují kation nebo anion, ale existují i elektroneutrální komplexní částice. Komplexní sloučeniny mohou být jednojaderné (s jedním centrálním atmem), i vícejaderné.

Historie
4Cl3-org.JPG.webp)
4Cl3-werner.jpg.webp)
Komplexní sloučeniny jsou známé již od počátků chemie, např. pruská modř. Jejich struktura byla, ale dlouhou dobu neznámá. Zásadní objevy v této oblasti učinil zakladatel koordinační chemie Alfred Werner, který byl za práci v této oblasti oceněn Nobelovou cenou za chemii roku (1913) za návrh oktaedrické struktury komplexů přechodných kovů.
Alfred Werner vyvrátil zažitou představu, kterou vytvořili organičtí chemici. Ti se domnívali, že koordinačně vázané skupiny či atomy, vytváří pevnou kovalentní vazbu. Vazebné číslo atomu bylo podle nich číslo skupiny, ve které se atom nacházel. Jako nejznámější příklad se uvádí kobaltité komplexy s koordinačně vázaným amoniakem. Podle organiků se na kobalt vázal amoniak kovalentní vazbou a dokonce několik amoniakových skupin za sebou. Problém spočíval v problematice izomerie. Některé kobaltité komplexy s amoniakem mají izomery, některé však ne. Organici nedokázali přesvědčivě vysvětlit proč některé sloučeniny izomery nemají, některé mají a proč jich je zrovna takový počet.
Alfred Werner vytvořil svou teorii údajně na základě svého snu a po probuzení ji za jedno dopoledne zpracoval. Založil ji na čistém sdílení elektronových párů. Poté zkoumal možné izomery komplexů s 6 ligandy a na základě svých pokusů zjistil, že jsou oktaedrické. Jak se i dnes ukazuje měl Werner ve většině případech pravdu. Jeho teorie je v podstatě používána až dodnes. I dnes je pro některé chemiky stále pozoruhodné s jakou vytrvalostí připravoval a zkoumal komplexní sloučeniny a pouze na základě svých poznatků určoval jejich strukturu, a to i bez dnešních moderních analytických metod. Strukturu oktaedrických komplexů určil na základě svých pokusů. Při připravování nových komplexních sloučenin totiž zkoumal geometrické izomery komplexů se 6 ligandy. Rovnoměrné rozložení 6 ligandů mohlo být ve tvaru hexagonu, trigonálního prizmatu nebo oktaedru. Werner si spočítal množství izomerů pro tyto možné varianty. Při svých pokusech se mu vždy podařilo získat maximálně 2 izomery dané sloučeniny a jelikož maximálně 2 izomery jsou možné pouze pro strukturu oktaedru, tak na tomto základě usoudil, že všechny koordinační sloučeniny se 6 ligandy jsou oktaedrické. Dnes se již ví, že to není úplná pravda, protože se podařilo připravit několik trigonálně prizmatických komplexů, ale v podstatě měl Werner pravdu.
Základní pojmy
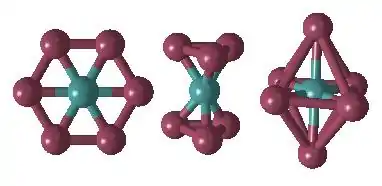
Centrální atom
Centrální atom je Lewisova kyselina, protože obsahuje volné orbitaly. Slouží jako akceptor (příjemce) elektronových párů od ligandů. Komplexy lze tedy za určitých okolností považovat za Lewisovy soli. Centrální atomy jsou nejčastěji d-prvky (přechodné kovy), existují i komplexy s s-prvky a p-prvky (např. Na3[AlF6]). Běžné komplexy obsahují pouze jeden centrální atom (jsou tzv. jednojaderné), ale existují i komplexy s více centrálními atomy (dvoujaderné, polyjaderné). V takovýchto vícejaderných komplexech mohou být centrálních atomy vázány spolu buď prostřednictvím ligandu (tzv. můstkový ligand) nebo přímo vazbou kov - kov. Komplexy, které obsahují tři nebo více centrálních atomů vázaných přímo vazbou kov – kov, se nazývají klastry (cluster=hnízdo).
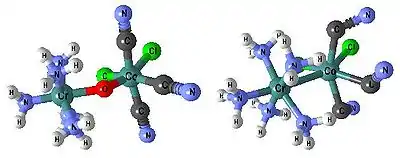
Ligand
Ligandy v komplexech vystupují nejčastěji jako Lewisovy báze, což jsou částice, které obsahují záporný náboj nebo alespoň volný elektronový pár. Velmi vzácně může být ligandem i kationt. Tato situace nastává například u hydrazinu, který přijal pouze jeden kation vodíku a díky toho má stále ještě jeden volný elektronový pár. Volný elektronový pár je v ligandu obvykle lokalizován na elektronegativním atomu (halogen, kyslík nebo dusík). Lze se setkat i s ligandy, které nemají žádný záporný náboj nebo volný elektronový pár a přesto tvoří komplexy. Tyto komplexy obsahují vhodný systém π-elektronů. Takovými ligandy jsou například benzen nebo ethyn.
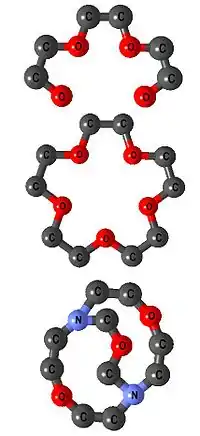
Ligandy se dělí podle své denticity. Podle počtu koordinačně kovalentních vazeb, které jsou schopny s centrálním atomem vytvořit. Ligandy se tedy dělí na jednovazné, dvojvazné, více vazné (monodentátní, bidentátní, polydentátní). Většinou je počet donorových atomů roven vaznosti ligandu. Výjimku tvoří ambidentátní ligandy. Tyto ligandy obsahují více donorových atomů, ale mohou se vázat pouze na centrální atom jedním z nich. Jako příklad slouží thiokyanatanový a izothiokyanatanový anion. Vícevazné ligandy, které se vážou na centrální atom více donorovými atomy, tvoří v struktuře cyklická uspořádání – tzv. chelátové kruhy. Takovým komplexům se říká cheláty. Tyto komplexy se mohou dále členit na speciální skupiny. Podle tvaru na podandy (lineární polyethery), koronandy neboli crowny (cyklické polyethery) a kryptandy (polycyklické polyethery). Komplexy s těmito ligandy se označují jako podáty, koronáty a kryptáty.
Koordinační sféra je soubor ligandů vázaných na centrální atom. Pokud jsou všechny ligandy vázané na centrální atom stejné, tak se tato sféra označuje jako homogenní. Pokud jsou na centrálním atomu různé druhy ligandů, tak se sféra označuje jako heterogenní. Koordinační číslo je množství vazeb mezi centrálním atomem a ligandy. Toto číslo je rovno počtu ligandů pouze v případě, že všechny ligandy jsou jednovazné.
Koordinační vazba
Koordinační vazba neboli koordinačně-kovalentní vazba je vazba vznikající v komplexních sloučeninách. V počátcích koordinační chemie bylo předpokládáno, že tato vazba vzniká mezi centrálním atomem (akceptorem elektronováho páru) a ligandy (donorem elektronového páru), čili že jde o sdílení elektronových párů a tedy tvorbu kovalentní vazby mezi centrálním atomem a ligandy. V úplných počátcích teorie koordinační vazby se navíc předpokládalo, že ligandy doplňují atomu přechodného kovu tolik elektronů, aby dosáhl stabilní konfigurace následujícího vzácného plynu - to by znamenalo, že pro každý atom je počet ligandů konstantní. Později byla tato teorie doplněna o možnost hybridizace atomu. Zhruba ve stejné době vytvořili fyzici teorii, která vysvětlovala magnetické a i spektrální vlastnosti (barevnost) komplexů. Pro chemiky bylo ovšem nepřijatelné, že se v této teorii vysvětlovala koordinační vazba pouze čistým elektrostatickým přitahováním mezi centrálním atomem a ligandy. Další teorie sjednotila dvě předchozí a vytvořila nefelauxetickou řadu, v níž byly ligandy seřazeny podle rostoucích schopností tvořit kovalentní charakter vazby. Doposud poslední, avšak nejsložitější teorií, dokonale popisuje všechny vlastnosti koordinačních sloučenin. Pro běžné používání je však nepraktická, jelikož je velmi složitá. V dnešní době se ale díky moderním počítačům používá stále častěji.
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu koordinační chemie na Wikimedia Commons
Obrázky, zvuky či videa k tématu koordinační chemie na Wikimedia Commons