Michaelova reakce
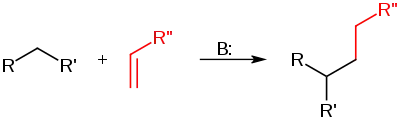
Michaelova reakce je nukleofilní adiční reakce karbaniontu nebo jiného nukleofilu[1][2] s α,β nenasycenou karbonylovou sloučeninou. Jedná se o jeden z nejvhodnějších způsobů tvorby vazeb C–C;[3] tato reakce má mnoho variant.[4]
Na výše uvedeném schématu jsou substituenty R a R' skupiny snižující elektronovou hustotu, jako například acylové nebo nitrilové skupiny, které způsobují kyselost methylenového uhlíku a v jejím důsledku tvorbu karbaniontu reakcí se zásadou B. Substituent aktivovaného alkenu, také nazývaný Michaelův akceptor, je většinou ketonová skupina, což z této látky dělá enon, lze ovšem použít i nitroskupinu.
Historie
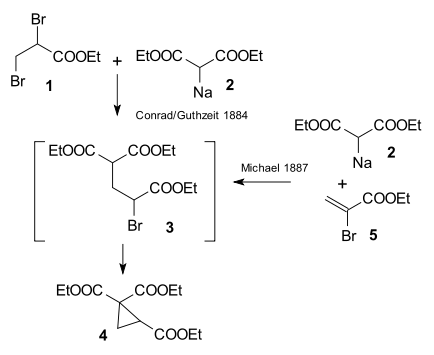
Výzkum prováděný Arthurem Michaelem roku 1887 byl inspirován výzkumem z roku 1884 týkajícím se reakce ethyl-2,3-dibrompropionátu s diethylmalonátem sodným za vzniku derivátu cyklopropanu.[5]
Arthur Michael dokázal získat stejný produkt, když propionát nahradil ethylesterem kyseliny 2-bromakrylové a předpokládal, že tato reakce může proběhnout jen pokud se jedná o adici na dvojnou vazbu kyseliny akrylové. Tento předpoklad potvrdil reakcí diethylmalonátu s ethylesterem kyseliny skořicové.[6]
Ve stejném roce oznámil stejný objev také Rainer Ludwig Claisen[7] poté, co v roce zkoumal produkty adicí na dvojné vazby jako vedlejší produkty kondenzačních reakcí kyseliny malonové s aldehydy.[8]
Definice
Arthur Michael[9][10] původně tento typ reakce definoval jako adici enolátu ketonu nebo aldehydu na β uhlík α,β nenasycené karbonylové sloučeniny. Podle novější definice jde o 1,4-adici dvojitě stabilizovaného uhlíkatého nukleofilu na α,β nenasycenou karbonylovou sloučeninu. Nukleofily zde mohou být mimo jiné beta ketoestery, malonáty a beta kyanoestery.
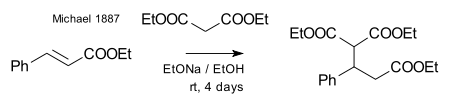
Příklady Michaelovy reakce jsou například reakce diethylmalonátu (sloužícího jako Michaelův donor) s diethylfumarátem (který je Michaelovým akceptorem)[11], mesityloxidem,[12] methylkrotonátem,[13] či reakce 2-nitropropanu s methylakrylátem.[14]
Michaelova adice je významnou metodou diastereoselektivní a enantioselektivní tvorby vazeb C-C. Často se spojuje s aldolovou reakcí do Robinsonovy anelace.
Mechanismus
Na níže uvedeném obrázku je sloučeninou 1 (kde R je alkoxyskupina) nukleofil:[3]
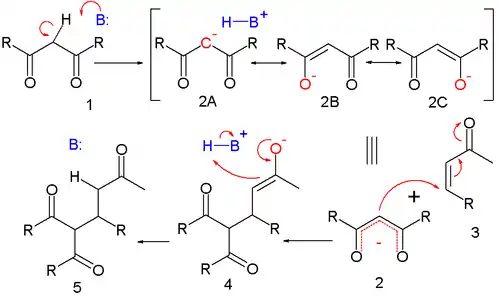 Mechanismus Michaelovy reakce
Mechanismus Michaelovy reakce
Deprotonací látky 1 pomocí zásady vzniká karbanion 2, který má rezonanční struktury 2a až 2c, z nichž dvě jsou enolátové ionty. Tento nukleofil reaguje s elektrofilním alkenem 3 za vzniku molekuly 4 (zde jde o nukleofilní konjugovanou adici). Odstraněním protonu z protonované zásady (nebo rozpouštědla) se následně vytváří konečný produkt 5. HOMO stabilizovaného enolátu má vysoký koeficient na centrálním uhlíkovém atomu, zatímco LUMO mnoha α,β nenasycených karbonylových sloučenin má vysoký koeficient na β uhlíku. karbonylovou sloučenin; podle teorie HSAB jde tak v obou případech o měkké reaktanty. Tyto polarizované orbitaly mají podobnou energii a účinně reagují za vzniku nové vazby C-C.
Asymetrická Michaelova reakce
Byla objevena řada druhů asymetrických variant Michaelovy reakce. K nejčastěji používaným metodám patří chirální katalýza fázového přenosu, při níž se používají chirální kvartérní amoniové sloučeniny odvozené od alkaloidů, a organokatalytické reakce, při nichž se využívá enaminová nebo iminiová aktivace za pomoci sekundárních aminů (často odvozených od prolinu).[15]
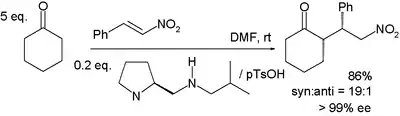
Při reakci cyklohexanonu s β-nitrostyrenem, jak je znázorněno níže, je molekula prolinu pozměněna a spojuje se s protickou kyselinou jako je například kyselina p-toluensulfonová.[16]
Syn adice zde má 99% enantiomerní přebytek.
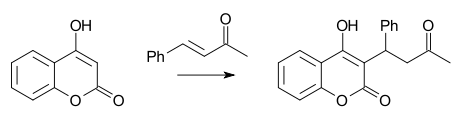
Michaelova reakce je také součástí syntézy warfarinu z 4-hydroxykumarinu a benzylidenacetonu, která byla popsána roku 1944.[17]
Existuje několik organokatalytických variant Michaelovy reakce.[18][19][20][21][22][23]
Mukaiyamova-Michaelova adice
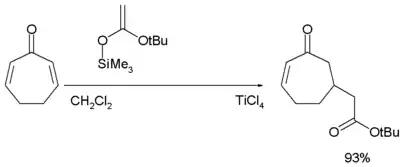
Mukaiyamova-Michaelova adice je reakce nukleofilu se silylenoletherem; jako katalyzátor se nejčastěji používá chlorid titaničitý.[24][25]
Reference
V tomto článku byl použit překlad textu z článku Michael reaction na anglické Wikipedii.
- LITTLE, R. D.; MASJEDIZADEH, M. R.; WALLQUIST, O.; MCLOUGHLIN, J. I. Organic Reactions. [s.l.]: [s.n.], 1995. ISBN 0-471-26418-0. DOI 10.1002/0471264180.or047.02. Kapitola The Intramolecular Michael Reaction, s. 315–552. (anglicky)
- MATHER, B.; VISWANATHAN, K.; MILLER, K.; LONG, T. Michael addition reactions in macromolecular design for emerging technologies. Progress in Polymer Science. 2006, s. 487–531. DOI 10.1016/j.progpolymsci.2006.03.001. (anglicky)
- Michael Addition | PharmaXChange.info
- Hunt, I. Chapter 18: Enols and Enolates – The Michael Addition reaction [online]. University of Calgary. Dostupné online. (anglicky)
- CONRAD, M.; GUTHZEIT, M. Ueber die Einwirkung von α-β-Dibrompropionsäure auf Malonsäureester. Berichte der Deutschen Chemischen Gesellschaft. 1884, s. 1185–1188. Dostupné online. DOI 10.1002/cber.188401701314. (anglicky)
- TOKOROYAMA, T. Discovery of the Michael Reaction. European Journal of Organic Chemistry. 2010, s. 2009–2016. DOI 10.1002/ejoc.200901130. (anglicky)
- CLAISEN, L. Bemerkung über die Addition von Aethylmalonat an Körper mit doppelter Kohlenstoffbindung. Journal für Praktische Chemie. 1887, s. 413–415. Dostupné online. DOI 10.1002/prac.18870350144. (anglicky)
- KOMNENOS, T. Ueber die Einwirkung von Fettaldehyden auf Malonsäure und Aethylmalonat. Justus Liebig's Annalen der Chemie. 1883, s. 145–167. Dostupné online. DOI 10.1002/jlac.18832180204. (anglicky)
- MICHAEL, A. Ueber die Addition von Natriumacetessig- und Natriummalonsäureäthern zu den Aethern ungesättigter Säuren. Journal für Praktische Chemie. 1887, s. 349–356. Dostupné online. DOI 10.1002/prac.18870350136. (anglicky)
- MICHAEL, A. Ueber die Addition von Natriumacetessig- und Natriummalonsäureäther zu den Aethern ungesättigter Säuren. Journal für Praktische Chemie. 1894, s. 20–25. Dostupné online. DOI 10.1002/prac.18940490103. (anglicky)
- CLARKE, H. T.; MURRAY, T. F. 1,1,2,3-Propanetetracarboxylic acid, tetraethyl ester. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 272. (anglicky)
- SHRINER, R. L.; TODD, H. R. 1,3-Cyclohexanedione, 5,5-dimethyl-. Org. Synth.. 1943. Dostupné online. (anglicky); Coll. Vol.. S. 200. (anglicky)
- JAMES CASON. β-Methylglutaric anhydride. Org. Synth.. 1963. Dostupné online. (anglicky); Coll. Vol.. S. 630. (anglicky)
- MOFFETT, R. B. Methyl γ-Methyl-γ-nitrovalerate. Org. Synth.. 1963. Dostupné online. (anglicky); Coll. Vol.. S. 652. (anglicky)
- REYES, E.; URIA, U.; VICARIO, J. L.; CARRILLO, L. The Catalytic, Enantioselective Michael Reaction. Organic Reactions. 2016, s. 1–898. Dostupné online. (anglicky)
- PANSARE, S. V.; PANDYA, K. Simple Diamine- and Triamine-Protonic Acid Catalysts for the Enantioselective Michael Addition of Cyclic Ketones to Nitroalkenes. Journal of the American Chemical Society. 2006, s. 9624–9625. DOI 10.1021/ja062701n. PMID 16866504. (anglicky)
- IKAWA, M.; STAHMANN, M. A.; LINK, K. P. Studies on 4-Hydroxycoumarins. V. The Condensation of α,β-Unsaturated Ketones with 4-Hydroxycoumarin. Journal of the American Chemical Society. 1944, s. 902. DOI 10.1021/ja01234a019. (anglicky)
- HALLAND, N.; HANSEN, T.; JØRGENSEN, K. Organocatalytic asymmetric Michael reaction of cyclic 1,3-dicarbonyl compounds and α,β-unsaturated ketones--a highly atom-economic catalytic one-step formation of optically active warfarin anticoagulant. Angewandte Chemie. 2003, s. 4955–4957. DOI 10.1002/anie.200352136. PMID 14579449. (anglicky)
- KIM, H.; YEN, C.; PRESTON, P.; CHIN, J. Substrate-directed stereoselectivity in vicinal diamine-catalyzed synthesis of warfarin. Organic Letters. 2006, s. 5239–5242. DOI 10.1021/ol062000v. PMID 17078687. (anglicky)
- XIE, J.; YUE, L.; CHEN, W.; DU, W.; ZHU, J.; DENG, J.; CHEN, Y. Highly Enantioselective Michael Addition of Cyclic 1,3-Dicarbonyl Compounds to α,β-Unsaturated Ketones. Organic Letters. 2007, s. 413–415. DOI 10.1021/ol062718a. PMID 17249775. (anglicky)
- KRISTENSEN, T. E.; VESTLI, K.; HANSEN, F. K.; HANSEN, T. New Phenylglycine-Derived Primary Amine Organocatalysts for the Preparation of Optically Active Warfarin. European Journal of Organic Chemistry. 2009, s. 5185. DOI 10.1002/ejoc.200900664. (anglicky)
- DONG, Z.; WANG, L.; CHEN, X.; LIU, X.; LIN, L.; FENG, X. Organocatalytic Enantioselective Michael Addition of 4-Hydroxycoumarin to α,β-Unsaturated Ketones: A Simple Synthesis of Warfarin. European Journal of Organic Chemistry. 2009, s. 5192. DOI 10.1002/ejoc.200900831. (anglicky)
- WONG, T. C.; SULTANA, C. M.; VOSBURG, D. A. A Green, Enantioselective Synthesis of Warfarin for the Undergraduate Organic Laboratory. Journal of Chemical Education. 2010, s. 194. DOI 10.1021/ed800040m. Bibcode 2010JChEd..87..194W. (anglicky)
- MUKAIYAMA, T. Titanium Tetrachloride in Organic Synthesis [New synthetic methods (21)]. Angew. Chem. Int. Ed. Engl.. 1977, s. 817–826. DOI 10.1002/anie.197708171. (anglicky)
- LIPPERT, A. R.; KAEOBAMRUNG, J.; BODE, J. W. Synthesis of Oligosubstituted Bullvalones: Shapeshifting Molecules Under Basic Conditions. Journal of the American Chemical Society. 2006, s. 14738–14739. DOI 10.1021/ja063900+. PMID 17105247. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Michaelova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Michaelova reakce na Wikimedia Commons