Hybridizace orbitalů
Hybridizace orbitalů je proces energetického sjednocení původně nerovnocenných atomových orbitalů. Hybridizují se ty orbitaly atomu, které poskytují své elektrony k vytvoření kovalentních σ-vazeb. Dojde k energetickému sjednocení orbitalů, přičemž se zachovává energetické těžiště, tzn. celková energetická hladina orbitalů po hybridizaci je rovna té před hybridizací. Přednostně vstupují do hybridizace ty orbitaly, které jsou na nižší energetické hladině, ale na stejné elektronové vrstvě (většinou se však do hybridizace zapojují pouze elektrony z valenční vrstvy). Například pro atom uhlíku, který má čtyři valenční elektrony umístěné v orbitalech 2s a 2p, platí, že se při vzniku tří σ-vazeb na tomto atomu budou hybridizovat dva z celkových tří p-orbitalů s jedním s-orbitalem – jedná se o hybridizaci sp2. Dle způsobu hybridizace lze předpovědět i geometrii vzniklé molekuly. Tvar molekuly totiž odpovídá tvaru os, ve kterých se hybridní atomové orbitaly nacházejí.
Vliv hybridizace na geometrii

| Druh hybridizace | Geometrie molekuly | vazebný úhel |
|---|---|---|
| sp | lineární | 180° |
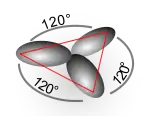
| sp2 | rovnostranný trojúhelník | 120° |
| sp3 | tetraedr | 109,5° |
| sp³d | hexaedr, trojboká dipyramida
(rovnostranný trojúhelník a z něj jedna vazba nahoru a jedna dolů) |
90°, 120° |
| sp³d² | oktaedr | 90° |
Postup hybridizace
| Methan – sp3 | ||
|---|---|---|
| Výchozí stav atomu C | Ve výchozím stavu má atom C pouze 2 nepárové elektrony. | |
| Excitovaný stav | Pohlcením energie přejde elektron z orbitalu 2s do energeticky vyššího orbitalu 2p. | |
| Hybridizace | Energie orbitalů 2s a 2p je blízká a dovoluje sjednocení – hybridizaci. Místo orbitalu s a tří orbitalů p vznikají 4sp³ hybridní orbitaly. | |
| 3D model |  |
Hybridizací se změní tvar orbitalů. Dále dochází k překryvu orbitalů 1s (H) a sp3 (C) za vzniku vazby σ |
Externí odkazy
 Obrázky, zvuky či videa k tématu hybridizace orbitalů na Wikimedia Commons
Obrázky, zvuky či videa k tématu hybridizace orbitalů na Wikimedia Commons