Organické sloučeniny železa
Organické sloučeniny železa jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a železa.[1][2] Tyto sloučeniny, například pentakarbonyl železa, nonakarbonyl diželeza a tetrakarbonylželeznatan disodný. Železo může zaujímat oxidační čísla Fe−II až FeVII, nejvyšší zaznamenané v organických sloučeninách je FeIV. I když je železo obecně katalyticky méně aktivní, tak je levnější a šetrnější k životnímu prostředí než ostatní kovy.[3]
Organoželezové sloučeniny mají využití jako ligandy; podobně jako ostatní organokovové sloučeniny upravují vlastnosti ligandů, jako jsou fosfiny, oxid uhelnatý a cyklopentadienyl, lze je ovšem použít i s „tvrdými“ ligandy, jako jsou aminy.
Sloučeniny s železem v oxidačních číslech 0 a nižších

Karbonyly
K významným karbonylům železa patří tři neutrální binární karbonyly, pentakarbonyl železa, nonakarbonyl diželeza a dodekakarbonyl triželeza. Jeden nebo více karbonylů v těchto sloučeninách lze nahradit řadou jiných ligandů, například alkeny nebo fosfiny.
Tetrakarbonylželeznatan disodný (Na2[Fe(CO)4]), komplex obsahující Fe2−, známý také jako „Collmanovo činidlo“, je možné připravit redukcí pentakarbonylu železa sodíkem. Tuto silně nukleofilní aniontovou sloučeninu lze dále alkylovat a karbonylovat za vzniku acylových derivátů, jež mohou podstoupit protonolýzu na aldehydy:[4]
- LiFe(CO)4(C(O)R) + H+ → RCHO (+ sloučeniny železa)
Podobné acyly lze získat reakcemi pentakarbonylu železa s organolithnými sloučeninami:
- ArLi + Fe(CO)5 → LiFe(CO)4C(O)R
Karboanion zde atakuje CO ligand. Obdobně lze Collmanovo činidlo použít na přeměnu acylchloridů na aldehydy. Podobných reakcí se také dá dosáhnout s využitím solí [HFe(CO)4]−.[5]
Sloučeniny alkenů Fe0-CO
Monoalkeny
Pentakarbonyl železa fotochemicky reaguje s alkeny za vzniku komplexů typu Fe(CO)4(alken).[6]
Dieny s Fe0-CO
Komplexy dienů a železa se obvykle připravují z Fe(CO)5 nebo Fe2(CO)9. Příslušné deriváty jsou známy od jednoduchých dienů, jako jsou cyklohexadien, norbornadien a cyklooktadien, ale i od cyklobutadienu lze vytvoří stabilizované sloučeniny. U komplexů buta-1,3-dienu má dien koinformaci cis. Karbonyly železa mohou být využity jako chránicí skupiny pro dieny, jež brání jejich hydrogenacím a Dielsovým–Alderovým reakcím. Trikarbonyl cyklobutadienželeza se připravuje z 3,4-dichlorcyklobutenu a Fe2(CO)9.
Cyclohexadieny, mnohdy získané Birchovou redukcí aromatickým sloučenin, vytváří komplexy typu (dien)Fe(CO)3. Afinita Fe(CO)3 ke konjugovaným dienům se projevuje v schopnosti karbonylů železa katalyzovat izomerizace cyklookta-1,5-dienu na cyklookta-1,3-dien. Z komplexů cyklookadienů mohou být odstraněny hydridové skupiny za vzniku cyklohexadienylových kationtů, na které se poté adují nukleofily. Odštěpením vodíků z cyclohexadienových komplexů Fe0 se tvoří sloučeniny Fe2+.[7][8]
Enonový komplex trikarbonyl (benzylidenaceton)železa slouží jako zdroj Fe(CO)3 jednotek při přípravách dalších derivátů. Využití má podobné jako Fe2(CO)9.
Alkyny s Fe0-CO
I alkyny vytvářejí komplexy s karbonyly železa, jako například ferroly (Fe2(C4R4)(CO)6), (p-1,4-benzochinon)Fe(CO)3, (cyklobutadien)Fe(CO)3 a mnoho dalších.[9]
Tri- a polyenové komplexy Fe0
Stabilní komplexy se železem, s CO ligandy i bez nich, jsou známy od mnoha polynenasycených uhlovodíků, jako jsou cykloheptatrien, azulen a bulvalen. Od cyklooktatetraenu (COT) jsou například známy deriváty Fe(COT)2,[10] Fe3(COT)3[11] a několik smíšených karbonylů (například Fe(COT)(CO)3 a Fe2(COT)(CO)6).
2.svg.png.webp)
FeI a FeII
Protože je oxidační číslo +2 u železa běžné, tak je znám i velký počet odpovídajících sloučenin. Sloučeniny FeI často obsahují vazby Fe-Fe, i když zde existují výjimky, jako například [Fe(antracen)2]−.[12]
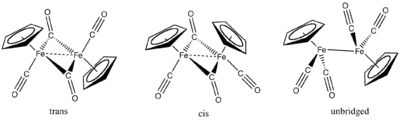 Dimer dikarbonylu cyklopentadienylželeza
Dimer dikarbonylu cyklopentadienylželeza
Ferrocen a jeho deriváty
Rychlý rozvoj organokovové chemie ve 20. století nastal s objevem ferrocenu, značně stálé sloučeniny, která předznamenala řadu dalších sendvičových sloučenin. Ferrocen se získává reakcí cyklopentadienidu sodného s chloridem železnatým:
- 2 NaC5H5 + FeCl2 → Fe(C5H5)2 + 2 NaCl
Ferrocen vykazuje na cyklopentadienylových ligandech různorodou reaktivitu, například Friedelovy–Craftsovy reakce a lithace. Některé elektrofilní funkcionalizace ovšem začínají atakem na Fe centru za tvorby meziproduktů se vzorcem [Cp2Fe–Z]+ (které obsahují železo v oxidačním čísle +4). Jako příklad lze uvést reakci HF:PF5 a Hg(OTFA)2, při které vznikají izolovatelné nebo spektroskopicky pozorovatelné komplexy [Cp2Fe–H]+PF6– a Cp2Fe+–Hg–(OTFA)2.[13][14][15]
Na zvláštnost struktury ferrocenu ukazuje také oblíbenost ligandů jako je 1,1'-bis(difenylfosfino)ferrocen, užitečbých v katalýze.[16] Reakcí ferrocenu s chloridem hlinitým a benzenem se vytváří kation [CpFe(C6H6)]+. Oxidací ferrocenu vzniká modrý 17elektronový ferroceniový kation. Jako vysoce substituované ligandy mohou být též použity deriváty fullerenů .
Fp2, Fp−, Fp+ a jejich deriváty
Fe(CO)5 reaguje s cyklopentadienem za vzniku dvojjaderné sloučeniny FeI nazývané dimer dikarbonylu cyklopentadienylželeza ([FeCp(CO)2]2), zkráceně Fp2. Pyrolýzou Fp2 vzniká [FeCp(CO)]4.
Stericky silně zatížené substituované cyklopentadienyly lze izolovat v monomerní formě, díky tomu byla například stanovena struktura Cpi-PrFe(CO)2 (Cpi-Pr = i-Pr5C5).[17]
Redukcí Fp2 sodíkem vzniká NaFp, silný nukleofil a prekurzor řady sloučenin typu CpFe(CO)2R.[18]
Sloučenina [FpCH2S(CH3)2]+ se používá při cyklopropanacích.[19] Komplex Cp(CO2)Fe+(η2-vinylether]+ obsahuje maskovaný vinylový kation.[20]
Sloučeniny Fp-R jsou prochirální a byly použity na přípravu chirálních molekul CpFe(PPh3)(CO)acyl.[21]
Alkylové, allylové a arylové sloučeniny
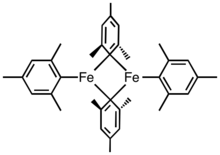
Jednoduché peralkylové a perarylové komplexy jsou méně běžné než komplexy Cp a CO; příkladem sloučeniny může být tetramesityldiželezo.
Sloučeniny typu [(η3-allyl)Fe(CO)4]+X− mají využití při allylových substitucích.[6] Sloučeniny popsatelné obecným vzorcem [(η5-C5H5)Fe(CO)2(CH2CH=CHR)] se vyznačují η1-allylovými skupinami a jsou podobné allylovým sloučeninám prvků hlavní skupiny (M je například B, Si nebo Sn) a reagují s uhlíkatými elektrofily za tvorby produktů allylací s SE2′ selekivitou.[22] Obdobně mají dikarbonylové komplexy allenyl(cyklopentadienyl)železa vlastnosti podobné allenylkovovým sloučeninám.[23]
Fe3+
Některé organoželezité sloučeniny je možné připravit oxidacemi příslušných sloučenin železnatých., jako příklad může být použito ferrocenium [(C5H5)2Fe]+. Je znám velký počet organoželezitých komplexů porfyrinů.
Fe4+
4.svg.png.webp)
V komplexu Fe(norbornyl)4 je čtyřmocné železo stabilizováno alkylovým ligandem odolným vůči beta-hydridové eliminaci.[26]
FeCy4, který je náchylný k beta-hydridové eliminaci, ovšem také byl izolován a krystalograficky prozkoumán, neboť je stabilní při –20 °C. Jeho neočekávaná stálost se připisuje stabilizačním disperzním silám a konformačním efektům, v jejichž důsledku je beta-hydridová eliminace nevýhodná.[27]
Dvoulelektronovou oxidací dekamethylferrocenu vzniká dikation [Fe(C5Me5)2]2+, který vy\tváří karbonylový komplex se vzorcem [Fe(C5Me5)2(CO)](SbF6)2.[28]
Použití
V organické syntéze a v katalýze
V průmyslové katalýze se komplexy železa používají méně často než sloučeniny organické sloučeniny kobaltu a niklu. Vzhledem k nízkým nákladům a malé toxicitě jsou sloučeniny železa oblíbenými stechiometrickými reaktanty.
K oblastem jejich využití patří:
- Hydrogenace a redukce, například katalyzátor nazývaný Knölkerův komplex.
- Křížová párování, kde sloučeniny jako je Fe(acac)3 katalyzují reakce Grignardových činidel s aryl-, alkenyl- nebo acyl halogenidy. V podobném Kumadově párování se používají katalyzátory založené na palladiu a niklu.
- Komplexy odvozené od Schiffových zásad jsou aktivními katalyzátory polymerizací alkenů.[29]
Biochemie
V rámci bioorganokovové chemie organické sloučeniny železa fungují jako aktivní místa několika enzymů, tří hydrogenáz a dehydrogenázy oxidu uhelnatého.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organoiron chemistry na anglické Wikipedii.
- Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. S. Komiya, M. Hurano 1997
- Carsten Bolm. Iron-Catalyzed Reactions in Organic Synthesis. Chemical Reviews. 2004, s. 6217–6254. DOI 10.1021/cr040664h.
- S. Enthaler; K. Junge; M. Beller. Sustainable Metal Catalysis with Iron: From Rust to a Rising Star?. Angewandte Chemie International Edition. 2008, s. 3317–3321. DOI 10.1002/anie.200800012. PMID 18412184.
- Richard G. Finke; Thomas N. Sorrell. Nucleophilic Acylation with Disodium Tetracarbonylferrate: Methyl 7-oxoheptanoate and Methyl 7-oxooctanoate. Organic Syntheses. 1979, s. 102. DOI 10.15227/orgsyn.059.0102.
- J. J. Brunet. Tetracarbonylhydridoferrates, MHFe(CO)4: Versatile Tools in Organic Synthesis and Catalysis. Chemical Reviews. 1990, s. 1041. DOI 10.1021/cr00104a006.
- D. Enders; B. Jandeleit; S. von Berg. (+)-(1R,2S,3R)-Tetracarbonyl[(1-3η)-1-(Phenylsulfonyl)- But-2-en-1-yl]iron(1+) Tetrafluoroborate. Organic Syntheses. 2002, s. 189. DOI 10.15227/orgsyn.078.0189.
- A. J. Birch; K. B. Chamberlain. Tricarbonyl[(2,3,4,5-η)-2,4-cyclohexadien-1-one]iron and Tricarbonyl[(1,2,3,4,5-η)-2-methoxy-2,4-cyclohexadien-1-yl]iron(1+) Hexafluorophosphate(1−) From Anisole. Organic Syntheses. 1977, s. 107. DOI 10.15227/orgsyn.057.0107.
- A. J. Birch; K. B. Chamberlain. Alkylation of Dimedone With A Tricarbonyl(Diene)iron Complex: Tricarbonyl[2-[(2,3,4,5-η)-4-methoxy-2,4-cyclohexadien-1-yl]-5,5-dimethyl-1,3-cyclohexanedione]iron. Organic Syntheses. 1977, s. 16. DOI 10.15227/orgsyn.057.0016.
- C. Hoogzand; W. Hubel. Organic Syntheses via Metal Carbonyls Volume 1. [s.l.]: Wiley, 1968. Dostupné online. ISBN 0-471-93367-8. Kapitola Cyclic Polymerization of Acetylenes by Metal Carbonyl Compounds.
- D. H. Gerlach, R. A. Schunn, Inorganic Syntheses volume 15, 2 (1974) DOI:10.1002/9780470132463.ch1
- Vincent Lavallo; Robert H. Grubbs. Carbenes As Catalysts for Transformations of Organometallic Iron Complexes. Science. 2009, s. 559–562. DOI 10.1126/science.1178919. PMID 19900894. Bibcode 2009Sci...326..559L.
- J. E. Ellis. The Chatt reaction: conventional routes to homoleptic arenemetalates of d-block elements. Dalton Transactions. 2019, s. 9538–9563. DOI 10.1039/C8DT05029E. PMID 30724934.
- Didier Astruc. Why is Ferrocene so Exceptional?. European Journal of Inorganic Chemistry. 2017, s. 6–29. ISSN 1099-0682. DOI 10.1002/ejic.201600983.
- Moritz Malischewski; Konrad Seppelt; Jörg Sutter; Frank W. Heinemann; Birger Dittrich; Karsten Meyer. Protonation of Ferrocene: A Low-Temperature X-ray Diffraction Study of [Cp2FeH](PF6) Reveals an Iron-Bound Hydrido Ligand. Angewandte Chemie International Edition. 2017, s. 13 372 – 13 376. ISSN 1521-3773. DOI 10.1002/anie.201704854. PMID 28834022.
- Allan F. Cunningham. Mechanism of Mercuration of Ferrocene: General Treatment of Electrophilic Substitution of Ferrocene Derivatives. Organometallics. 1997-03-01, s. 1114–1122. ISSN 0276-7333. DOI 10.1021/om960815+.
- Petr Stepnicka "Ferrocenes: Ligands, Materials and Biomolecules" J. Wiley, Hoboken, 2008. ISBN 0-470-03585-4
- SITZMANN, Helmut; DEZEMBER, Thomas; KAIM, Wolfgang; BAUMANN, Frank; STALKE, Dietmar; KÄRCHER, Joerg; DORMANN, Elmar. Synthesis and Characterization of the Stable Dicarbonyl(cyclopentadienyl)iron Radical [(C5R5)Fe(CO)2] (R CHMe2). Angewandte Chemie International Edition in English. 1996, s. 2872–2875. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.199628721. (anglicky)
- Keith H. Pannell; Hemant K. Sharma. (Cyclopentadienyl)dicarbonylmethyliron ((η5-C5H5)Fe(CO)2CH3, FpMe), a Seminal Transition-Metal Alkyl Complex: Mobility of the Methyl Group. Organometallics. 2010, s. 4741–4745. DOI 10.1021/om1004594.
- MATTHEW N. MATTSON; EDWARD J. O'CONNOR; PAUL HELQUIST. Cyclopropanation using an Iron-Containing Methylene Transfer Reagent: 1,1-Diphenylcyclopropane. Org. Synth.. 1998. Dostupné online. (anglicky); Coll. Vol.. S. 372. (anglicky)
- Tony C. T. Chang; Myron Rosenblum; Nancy Simms. Vinylation Of Enolates with a Vinyl Cation Equivalent: trans-3-Methyl-2-vinylcyclohexanone. Organic Syntheses. 1988, s. 95. DOI 10.15227/orgsyn.066.0095.
- Karola Rück-Braun "Iron Acyl Complexes" in Transition Metals for Organic Synthesis. Vol. 1. 2nd Ed., M. Beller, C. Bolm, Eds. Wiley-VCH, 2004, Weinheim ISBN 3-527-30613-7
- CUTLER, A.; EHNHOLT, D.; LENNON, P.; NICHOLAS, K.; MARTEN, David F.; MADHAVARAO, M.; RAGHU, S. Chemistry of dicarbonyl .eta.5-cyclopentadienyliron complexes. General syntheses of monosubstituted .eta.2-olefin complexes and of 1-substituted .eta.1-allyl complexes. Conformational effects on the course of deprotonation of (.eta.2-olefin) cations. Journal of the American Chemical Society. 1975-05-01, s. 3149–3157. ISSN 0002-7863. DOI 10.1021/ja00844a038. (anglicky)
- Yidong Wang; Jin Zhu; Austin C. Durham; Haley Lindberg; Yi-Ming Wang. α-C–H Functionalization of π-Bonds Using Iron Complexes: Catalytic Hydroxyalkylation of Alkynes and Alkenes. Journal of the American Chemical Society. 2019-12-18, s. 19 594 – 19 599. ISSN 0002-7863. DOI 10.1021/jacs.9b11716. PMID 31791121.
- King, R. B., "Organosulfur Derivatives of Metal Carbonyls. I. The Isolation of Two Isomeric Products in the Reaction of Triiron Dodecacarbonyl with Dimethyl Disulfide", Journal of the American Chemical Society, 1962, 84, 2460
- Pascal Doppelt. Molecular stereochemistry of low-spin five-coordinate phenyl(meso-tetraphenylporphyrinato)iron(III). Inorganic Chemistry. S. 4009–4011. DOI 10.1021/ic00192a033.
- B. K. Bower; H. G. Tennent. Transition metal bicyclo[2.2.1]hept-1-yls. Journal of the American Chemical Society. 1972, s. 2512–2514. DOI 10.1021/ja00762a056.
- Alicia Casitas; Julian A. Rees; Richard Goddard; Eckhard Bill; Serena DeBeer; Alois Fürstner. Two Exceptional Homoleptic Iron(IV) Tetraalkyl Complexes. Angewandte Chemie International Edition. S. 10 108 – 10 113. Dostupné online. DOI 10.1002/anie.201612299.
- Moritz Malischewski; Konrad Seppelt; Jörg Sutter; Dominik Munz; Karsten Meyer. A Ferrocene-Based Dicationic Iron(IV) Carbonyl Complex. Angewandte Chemie International Edition. 2018, s. 14 597 – 14 601. ISSN 1521-3773. DOI 10.1002/anie.201809464. PMID 30176109.
- Allan, L. E. N.; Shaver, M. P.; White, A. J. P. and Gibson, V. C., "Correlation of Metal Spin-State in alpha-Diimine Iron Catalysts with Polymerization Mechanism", Inorg. Chem., 2007, 46, 8963-8970.
Literatura
- The Organic Chemistry of Iron. Redakce E. A. Koerner von Gustorf. [s.l.]: Academic Press, 1978. ISBN 978-0-12-417101-5. DOI 10.1016/B978-0-12-417101-5.X5001-X. (anglicky)
iron-tricarbonyl-3D-balls.png.webp)