Cykloheptatrien
Cykloheptatrien je organická sloučenina se vzorcem C7H8, obsahující kruh se sedmi atomy uhlíku, čtyřmi jednoduchými a třemi dvojnými vazbami. Používá se jako ligand v organokovové chemii a jako stavební prvek v organické syntéze. Není aromatický, protože jeho methylenový můstek (-CH2-) není ve stejné rovině jako ostatní atomy; tuto vlastnost ovšem má jemu podobný tropyliový kation.
| Cykloheptatrien | |
|---|---|
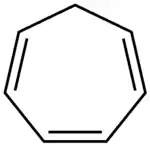
Strukturní vzorec | |
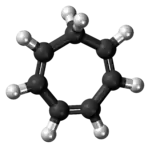
Model molekuly | |
| Obecné | |
| Systematický název | cyklohepta-1,3,5-trien |
| Ostatní názvy | 1H-[7]annulen |
| Sumární vzorec | C7H8 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 544-25-2 |
| EC-no (EINECS/ELINCS/NLP) | 208-866-3 |
| PubChem | 11000 |
| ChEBI | 37519 |
| SMILES | C1C=CC=CC=C1 |
| InChI | 1S/C7H8/c1-2-4-6-7-5-3-1/h1-6H,7H2 |
| Vlastnosti | |
| Molární hmotnost | 92,138 g/mol |
| Teplota tání | −79,5 °C (193,6 K)[1] |
| Teplota varu | 117 °C (390 K)[1] |
| Hustota | g/cm3 |
| Rozpustnost ve vodě | g/100 ml |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H301 H304 H311 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P270 P271 P280 P301+310 P302+352 P303+361+353 P304+340 P305+351+338 P312 P321 P322 P330 P331 P332+313 P337+313 P361 P362 P363 P370+378 P403+233 P403+235 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Cykloheptatrien poprvé připravil Albert Ladenburg v roce 1881 rozkladem tropinu;[2][3] strukturu určil Richard Willstätter roku 1901 po přípravě z cykloheptanonu.[4]
V laboratoři lze cykloheptatrien získat fotochemicky z benzenu a diazomethanu nebo pyrolýzou aduktu cyklohexenu a dichlorkarbenu.[5]
Podobným postupem, sloužícím k přípravě derivátů cykloheptatrienu, je Buchnerovo rozšiřování kruhu, jež začíná reakcí benzenu s ethyldiazoacetátem na příslušný ethylester norkadienu, který následně podstupuje elektrocyklické rozšiřování kruhu za vzniku ethylesteru kyseliny cyklohepta-1,3,5-trien-7-karboxylové.[6][7]

- Příklady
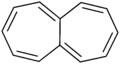 Heptalen – obsahuje dva spojené cykloheptatrienové kruhy.
Heptalen – obsahuje dva spojené cykloheptatrienové kruhy.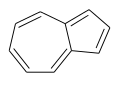 Azulen – má spojený cyklopentadienový a cykloheptatrienový kruh.
Azulen – má spojený cyklopentadienový a cykloheptatrienový kruh.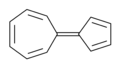 Seskvifulvalen – cyklopentadien a cykloheptatrien spojené chemickou vazbou
Seskvifulvalen – cyklopentadien a cykloheptatrien spojené chemickou vazbou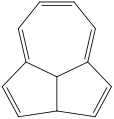 Elasovalen – jeden cykloheptatrienový a dva spojené cyklopentenové kruhy
Elasovalen – jeden cykloheptatrienový a dva spojené cyklopentenové kruhy Tropon – obsahuje cykloheptatrienové jádro a karbonylovou skupinu.
Tropon – obsahuje cykloheptatrienové jádro a karbonylovou skupinu. Tropolon – cykloheptatrienové jádro, karbonylová a hydroxylová skupina
Tropolon – cykloheptatrienové jádro, karbonylová a hydroxylová skupina Hinokitiol – obsahující cykloheptatrienový kruh, isopropylovou, karbonylovou a hydroxylovou skupinu (isopropylcykloheptatrienolon).
Hinokitiol – obsahující cykloheptatrienový kruh, isopropylovou, karbonylovou a hydroxylovou skupinu (isopropylcykloheptatrienolon).
Reakce a použití
Odštěpením hydridového iontu z methylenového můstku vzniká rovinný a aromatický cykloheptatrienový kation, také nazývaný tropyliový kation. Získat jej lze pomocí chloridu fosforečného.[8]
Cykloheptatrien může vstupovat do Dielsových–Alderových reakcí, kde funguje jako dien.
Je také známa řada komplexních sloučenin cykloheptatrienu, například Cr(CO)3(C7H8)[9] a trikarbonyl (cykloheptatrien)molybdenu.[10]
3.png.webp)
Cykloheptatrien se rovněž, společně s cyklooktatetraenem, používá v barvivových laserech využívajících rhodamin 6G.[11][12]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Cycloheptatriene na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/11000
- A. Ladenburg. Die Constitution des Atropins. Justus Liebig's Annalen der Chemie. 1883, s. 74–149. Dostupné online. DOI 10.1002/jlac.18832170107.
- A. Ladenburg. Die Zerlegung des Tropines. Berichte der Deutschen Chemischen Gesellschaft. 1881, s. 2126–2131. Dostupné online. DOI 10.1002/cber.188101402127.
- Richard Willstätter. Synthesen in der Tropingruppe. I. Synthese des Tropilidens. Justus Liebig's Annalen der Chemie. 1901, s. 204–265. Dostupné online. DOI 10.1002/jlac.19013170206.
- H. E. Winberg. Synthesis of Cycloheptatriene. Journal of Organic Chemistry. 1959, s. 264–265. DOI 10.1021/jo01084a635.
- Buchner, et al., Ber., 18, 2377 (1885);
- Irvin Smith Lee; O. Tawney Pliny. Studies on the Polymethylbenzenes. IX. Addition of Ethyl Diazoacetate to Durene. Journal of the American Chemical Society. 1934, s. 2167–2169. DOI 10.1021/ja01325a054.
- K. Conrow. Tropylium Fluoroborate. Organic Syntheses. 1973, s. 1138. Dostupné online. DOI 10.1021/ja01325a054.
- JAMES H. RIGBY, KEVIN R. FALES. 7α-ACETOXY-(1Hβ, 6Hβ)-BICYCLO[4.4.1]UNDECA-2,4,8-TRIENE VIA CHROMIUM-MEDIATED HIGHER ORDER CYCLOADDITION. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 1. (anglicky)
- Malcolm L. H. Green; Dennis K. P. Ng. Cycloheptatriene and -enyl Complexes of the Early Transition Metals. Chemical Reviews. 1995, s. 439–473. DOI 10.1021/cr00034a006.
- Tomi Nath Das; K. Indira Priyadarsini. Triplet of Cyclooctatetraene : Reactivity and Properties. Journal of the Chemical Society, Faraday Transactions. 1994, s. 963–968. DOI 10.1039/ft9949000963.
- R. Pappalardo; H. Samelson; A. Lempicki. Long Pulse Laser Emission From Rhodamine 6G Using Cyclooctatetraene. Applied Physics Letters. 1970, s. 267–269. DOI 10.1063/1.1653190. Bibcode 1970ApPhL..16..267P.



